初三下学期化学期末考试试题
时间:60分钟 分值:100分
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 Ca—40
一、选择题(每小题只有一个选项符合题意。20小题,每小题3分,共60分。)
1、《京都议定书》于2005年2月16日正式生效,它的核心内涵是:减少温室气体的排放量,以控制全球的气候变暖。导致温室效应的主要气体是( )
A、氧气 B、氢气 C、二氧化碳 D、氮气
2、下列各说法正确的是( )
A、有发光放热现象的变化一定是燃烧
B、剧烈的燃烧都会引起爆炸
C、爆炸一定属于化学变化
D、燃烧一定伴随发光、放热现象
3、青色的生虾煮熟后颜色会变成红色。一些同学认为这种红色物质可能就象酸碱指示剂一样,遇到酸或碱的溶液颜色会发生改变。这些同学的看法属于科学探究中的( )
A、实验 B、假设 C、观察 D、做结论
4、发生火灾时,下列做法不正确的是( )
A、炒菜时油锅着火,立即盖上锅盖
B、将森林大火蔓延路线前的树木砍掉
C、室内起火时,立即打开所有门窗通风
D、火灾中所处烟雾较浓时,应用湿毛巾捂住口鼻,并尽量贴近地面逃离
5、日常生活中常见的下列物质的水溶液能使红色石蕊试纸变蓝的是( )
A、蒸馏水 B、食盐 C、石灰水 D、食醋
6、我们要增强安全和自我保护意识。下列物质与空气(或氧气)混合,遇明火不爆炸的是( )
A、甲烷 B、氢气 C、一氧化碳 D、二氧化碳
7、煤的气化是提高煤的利用率、减少环境污染的有效措施。煤的气化过程中发生了化学反应:
C+H2O(气) ![]() H2+CO,反应前后,发生了变化的是( )
H2+CO,反应前后,发生了变化的是( )
A、元素的种类 B、分子的种类 C、原子的数目 D、物质的总质量
8、长期盛放石灰水的试剂瓶内壁常有一层白色固体物质,要将其除掉可选用( )
A、汽油 B、稀盐酸 C、酒精 D、水
9、确定气体的实验室制取,不需要考虑的是( )
A、实验装置 B、反应所需的药品和反应的条件
C、气体的验证方法 D、气体的用途
10、电解水与分解过氧化氢都可产生氧气,要制取相同质量的氧气,水与过氧化氢的质量比是( )
A、9:17 B、1:1 C、17:9 D、无法确定
11、消防队用水灭火主要是因为( )
A、水不能燃烧也不支持燃烧 B、降低可燃物的温度低于着火点
C、降低可燃物的着火点 D、 上述A与C的双重作用
12、科学家研发出一种以甲醇、氢氧化钾(KOH)为原料,用于手机的高效燃料电池。氢氧化钾(KOH)属于( )
A、 氧化物 B、盐 C、碱 D、酸
13、根据图中所示物质的pH,判断下列说法正确的是( )
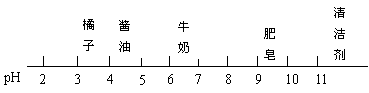
A、清洁剂显碱性 B、肥皂液显中性
C、牛奶酸性比酱油强 D、胃酸过多的人可多吃橘子
14、物质性质决定它的用途,还决定了它的保存方法。
固体NaOH具有以下性质:①白色片状固体;②有腐蚀性;③易吸收水分而潮解;④极易溶于水,溶解时放热;⑤能与空气中的二氧化碳反应。
实验室中必须将它密封保存的主要原因是 ( )
A、①② B、①②③ C、②③④ D、③⑤
15、“神舟六号”的成功发射与回收,表明我国的载人航天技术已经进入世界领先水平。在飞船的火箭推进器中常装有液态肼(用X表示)和液态双氧水(H2O2),它们混合时的反应方程式为:2H2O2 + X ===N2+4H2O。则肼的化学式是( )
A、N2H4 B、N2H6 C、NH2 D、N2H4O2
16、许多化学物质是一柄“双刃剑”,对CO2利弊的评价不妥的是( )
A、大气中CO2过多会造成“温室效应”
B、碳酸水浇灌植物对植物进行光合作用和改良碱性土壤都有利
C、利用干冰可进行人工降雨
D、大气层中CO2越多,抵御紫外线的作用越强
17、能源的开发和利用关系到社会的进步和发展,有关能源的认识错误的是( )
A、化石燃料是不可再生能源
B、使用天然气不会对环境造成任何污染
C、乙醇汽油的使用可以节省石油资源,减少汽车尾气的污染
D、开发新能源可解决能源短缺问题
18、人的胃液是一种呈酸性(含盐酸)的液体,pH 为 0.9~1.5 。正常人血液的pH为7.35~7.45,与胃液相比,其H+离子浓度要低几百万倍。己知质量分数为 0.37%的盐酸的pH约为l,质量分数为0.37‰的盐酸的pH约为2。那么下列哪种说法是正确的( )
A、 胃液中含盐酸的质量分数明显小于0.37% B、胃液与血液都呈酸性
C、 pH与溶液的H+离子浓度之间呈正比例关系 D、人体的血液呈弱碱性
19、下列说法不正确的是( )
A、中和反应一定生成盐和水 B、生成盐和水的反应不都是中和反应
C、盐溶液一定呈中性 D、pH=0的溶液呈酸性
20、某物质4.6g, 在氧气中完全燃烧,生成8.8g CO2和5.4 g H 2O, 则该物质可能为( )
A、C2H5OH B、C2H2 C、CH4 D、C3H8
二、填空题(共18分)
21、在实验室里,可以用 和 (填写物质名称)反应来制备二氧化碳气体,反应的化学方程式是 。
22、煤在空气中完全燃烧后的主要产物是 ,有时会闻到一股刺激性气味,原因是 。
23、pH的取值范围一般是从 到 。用pH试纸测定溶液酸碱度的正确操作是 。
24、某些金属氢化物(其中氢显—l价)与水反应可生成碱和氢气,如NaH+H2O = NaOH+H2↑,CaH2与H2O的反应和NaH相似。试用化学方程式表示CaH2与H2O发生的化学反应:_______________________________。
三、实验题(共12分)
25、实验老师整理药品时,拿出一瓶久置的氢氧化钙粉末[Ca(OH)2)],他让小王和大伟对这瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经生成碳酸钙(CaCO3)而变质?
(2)进行猜想:
①氢氧化钙全变为碳酸钙;②氢氧化钙部分变为碳酸钙;③氢氧化钙没有变质。
(3)设计实验方案、进行实验:下表是对猜想①进行实验探究的过程示例:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 | ①滤液不变色 ②有气泡产生 | 氢氧化钙全部 变为碳酸钙 |
请你另选择一种猜想参与探究,完成下表。
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,加适量水搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 | ① | |
| ② |
(4)原理与用途:
①农业上一般采用氢氧化钙改良_____性土壤。(填“酸”或“碱”)
②氢氧化钙变质是由于与空气中的________(填“化学式”)发生反应的缘故,反应的化学程式是:_____________________________。
四、计算题(共10分)
26、含碳酸钙质量分数为80%的石灰石跟105.4g稀盐酸恰好完全反应,生成气体的质量为4.4g。(假定石灰石中的杂质不溶于水且不跟稀盐酸反应。)试求:
(1)石灰石的质量为多少克?
(2)反应后所得溶液的溶质质量分数为多少?
初三下学期化学期末考试试题答案
一、选择题(60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | D | B | C | C | D | B | B | D | A | B | C | A | D | A | D | B | D | C | A |
二、填空题(18分,每空2分)
![]() 21、石灰石、稀盐酸 CaCO3+2HCl=CaCl2+H2O+CO2
21、石灰石、稀盐酸 CaCO3+2HCl=CaCl2+H2O+CO2
22、CO2 、煤中含有硫元素,燃烧时生成的SO2刺激性气味。
23、0 、14 用玻璃棒蘸取待测液滴在 pH试纸上,将pH试纸显示的颜色跟标准比色卡对照,即可测得pH。
![]() 24、Ca H2+2H2O
=Ca(OH)2+ 2H2
24、Ca H2+2H2O
=Ca(OH)2+ 2H2
三、实验题(12分,每空2分)
25、略
四、计算题(10分)
26、(1)12.5g
(2)10%