全国初中化学素质和实验能力竞赛
模拟试卷
可能用到的相对原子质量H1 C12 N14 O16 Na23 Mg24Al27 S32 Cl35.5 K39 Ca40 Cu64 Zn65 Ag108 Ba137
(满分100分 考试时间:120分钟)
一、 选择题(本题包括16个小题,每小题2分,共32分。每小题有1个或2个选项符合题意。若有2个答案的,错1个不得分,漏选1个扣1分。)
1、为了减少大气污染,许多城市推广汽车用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是( )
A、碳氢化合物 B、碳氧化合物 C、氢气 D、碳氢化合物
2、下列符合“化学反应的绿色化原则”的是( )
A、2C2H4+O2→2C2H4O(C2H4O为期望产品)
B、实验室制取CO2
C、2M+N=CuSO4+H2O FE+CuSO4=FeSO4+Cu
D、用铁屑、氧化铜、稀硫酸为原料制取铜;
3、人类的认识过程是一个不断深化的过程。在初中,我们从得氧失氧的角度认识了氧化还原反应;在高中,我们将从元素原子得失电子的角度来认识氧化还原反映,而元素原子得失电子表现为元素化合价的变化。因此“元素化合价有升降的化学反映是氧化还原反映。”据判断下列化学反应属于氧化还原的有 ( )
A Zn+H2SO4=ZnSO4+H2↑ B Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
C Na2CO3+2HCl=2NaCl+H2O+CO2↑ D CaCO3![]() CaO+CO2↑
CaO+CO2↑
4、质子和中子都是由u夸克和d夸克组成,u夸克带电量为![]() e,d夸克带电量为
e,d夸克带电量为![]() e,e为基元电荷。下列论断可能正确的是( )
e,e为基元电荷。下列论断可能正确的是( )
A 质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
B质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成
C质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
D质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成
5、近年来发现海底蕴藏着大量天然气水合物----“可燃冰”,其贮藏量超过已知天然气、石油和煤蕴藏量总合的2倍,是目前开发前景十分诱人的新能源。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼内可容纳1个甲烷分子或1个游离的水分子。若晶体中每8个笼有6个容纳了甲烷分子,另外两个被水分子填充。则“可燃冰”的平均分子组成为( )
A CH4•5H2O B CH4•6H2O C CH4•7H2O D CH4•8H2O
6、有如下四种可供选择的仪器用于量取一定体积的溶液,要求所量的体积越准确越好,现在要量取10mL20%的NaOH溶液,你认为应选择的仪器是( )
 A 50mL烧杯 B 20mL量筒 C 10mL量筒 D 烧杯和托盘天平
A 50mL烧杯 B 20mL量筒 C 10mL量筒 D 烧杯和托盘天平
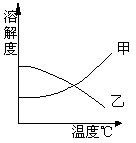 7、甲、乙两种固体的溶解度曲线如右图。室温下(20℃)将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体)。放进盛有冰水的烧杯里,则下列说法正确的是( )
7、甲、乙两种固体的溶解度曲线如右图。室温下(20℃)将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体)。放进盛有冰水的烧杯里,则下列说法正确的是( )
A 甲溶液中溶质质量分数增大 B 乙试管中剩余的固体减少
C 试管里甲、乙物质的溶解度都增大 D试管里甲、乙两溶液中的溶质都减少
8、下列括号中的物质是除去杂质所需的药品,其中错误的是( )
A NaCl中有杂志Na2SO4(硝酸钡溶液) B SO2中有少量HCl气体(氢氧化钠溶液)
C FeSO4中有杂质CuSO4(铁粉) D CO2中有少量CO(灼热的氧化铜)
9、在已调平的天平两端各放一个等质量的烧杯,向烧杯中各注入质量相等、溶质质量分数也相等的足量稀硫酸。在左边烧杯中投入一定质量的金属X粉末,同时在右边烧杯中投入与X等质量的金属Y粉末。观察到天平的指针县偏向左边,当两种金属完全溶解后,天平的指针偏向右边。则X、Y是下表组合中的( )
| A | B | C | D | |
| X | Mg | Zn | Zn | Fe |
| Y | Fe | Mg | Fe | Zn |
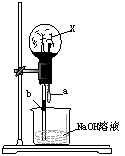 10、现代城市中有各类喷泉,其原理都是利用了水的压强差,化学中的喷泉原理与其相似,应用了少平内外的压强差。如图所示,烧杯内盛有NaOH溶液,滴管a中有NaOH溶液,实验时,先从滴管a处挤入几滴NaOH溶液,随即打开止水夹b,若要形成喷泉,少平内的气体X可以是( )
10、现代城市中有各类喷泉,其原理都是利用了水的压强差,化学中的喷泉原理与其相似,应用了少平内外的压强差。如图所示,烧杯内盛有NaOH溶液,滴管a中有NaOH溶液,实验时,先从滴管a处挤入几滴NaOH溶液,随即打开止水夹b,若要形成喷泉,少平内的气体X可以是( )
ASO2 BCO C H2 D HCl
11、二氧化碳在大气中含量增大是导致温室效应的主要原因,下列反应属于自然界缓解温室效应的是( )
A CO2+H2O=H2CO3 B 6CO2+6H2O![]() C6H12O6+6 O2
C6H12O6+6 O2
C CO2+C![]() 2CO D
CO2+NH3+H2O=NH4HCO3
2CO D
CO2+NH3+H2O=NH4HCO3
12、溶液的碱性强弱根溶液中OH-数量有关。一定体积的溶液中OH-数量越多,则溶液的碱性越强。10%的NaOH溶液(密度为1.1g/cm3)与10%的KOH(溶液密度也为1.1g/cm3)相比较,碱性更强的是( )
A NaOH B KOH C 一样强 D 无法比较
13、下表表示夏季某些湖泊随水深不同,水温和水中溶解氧的变化情况。收集这些数据是为了研究一些问题。下列问题中,不属于该项研究的是( )
| 水深(m) | 水面 | 1 | 3 | 5 | 7 | 9 | 11 | 13 | 15 | 17 | 19 | 21 |
| 水温(℃) | 23 | 22 | 21 | 20 | 15 | 10 | 6 | 5 | 5 | 4 | 4 | 4 |
| 溶解氧(mg/100mL) | 12 | 12 | 11 | 9 | 6 | 4 | 3 | 3 | 3 | 2 | 2 | 2 |
A鱼有时游到湖面甚至将嘴深处湖面进行呼吸的原因是什么
B水温和溶解氧与阳光能射入湖水的深度之间的关系是什么
C浮游植物主要在近水面出生长的原因是什么
D湖泊中的溶解氧主要是来自空气中的氧吗
14、1923年丹麦化学家布朗斯台特提出一种理论叫酸碱质子论,人为规定凡是能够释放质子(H+)的任何物质(包括分子或离子)都是酸,任何能接受质子的分子或离子都是碱,根据这一理论,下列各项即属于酸又属于碱的是( )
A HNO3 B H2SO4 C OH- D HCO3-
15、应用储能介质(某种结晶水合物)储存和再利用太阳能是一项新技术,其原理是:当白天阳光照射时,储能介质熔化,同时吸收热能;当夜晚环境降温时,储能介质凝固,同时释放出热能。某地区白天可达约40℃,夜晚时可下降至-10℃,根据以上原理和表中数据,该地区应用上述技术调节室温时,所选用的储能介质最好是表中的( )
| 选项 | 结晶水合物 | 熔点/℃ | 熔化时吸热/(KJ•g-1) |
| A | CaCl2•6H2O | 29.0 | 0.172 |
| B | Na2SO4•10H2O | 32.4 | 0.239 |
| C | Na2HPO4•12H2O | 36.1 | 0.282 |
| D | Na2S2O3•5H2O | 48.5 | 0.200 |
16、已知氧化还原反应中存在如下关系:强氧化剂+强还原剂→弱还原剂+弱氧化剂,现有下列三个能反应的式子:2W-+X2→2X-+W2;2Y-+W2→2W-+Y2;2X-+Z2→2Z-+X2
以上反应均在同温、同压、同浓度下进行,正确的结论是( )
A 氧化性是:Y2>X2 B 还原性是:Y->Z-
C 2Z-+Y2→2Y-+Z2的反应能够进行 D 在X-、Y-、W-、Z-中X-的还原性最强
二、填空与简答题(本题包括5小题,共24分)
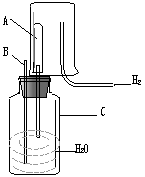 17、(4分)已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小。图中容器A是一种特制的有底的素瓷烧筒,他的壁可以通过气体分子。实验开始时,A中和烧杯中部充满空气。当向烧杯中持续同如氢气时,导管B处发生的现象是
,产生这种现象的原因是
。
17、(4分)已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小。图中容器A是一种特制的有底的素瓷烧筒,他的壁可以通过气体分子。实验开始时,A中和烧杯中部充满空气。当向烧杯中持续同如氢气时,导管B处发生的现象是
,产生这种现象的原因是
。
18、(4分)新型材料纳米级![]() -Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。实验室采用气相还原法制备纳米级
-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。实验室采用气相还原法制备纳米级![]() -Fe,方法是:将固体粉料FeCl2•nH2O脱水、真空干燥,然后在高温条件下通入高纯度氮气(作保护气)和氢气(作还原剂)的混合气体,生成纳米级
-Fe,方法是:将固体粉料FeCl2•nH2O脱水、真空干燥,然后在高温条件下通入高纯度氮气(作保护气)和氢气(作还原剂)的混合气体,生成纳米级![]() -Fe。请回答以下问题:
-Fe。请回答以下问题:
(1)写出生成纳米级![]() -Fe 的化学方程式
。
-Fe 的化学方程式
。
(2)反应保护气的作用是 。
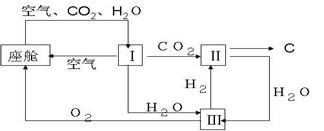 19、(4分)航天飞行器座舱内空气跟新过程如图所示:
19、(4分)航天飞行器座舱内空气跟新过程如图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式 。
(不必注明反应条件)。
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,如果宇航员每天消耗0.896KgO2,呼出1.012KgCO2,则宇航员每天呼出的气体中含H2O Kg。
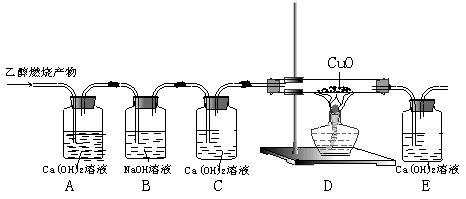 20、(6分)乙醇(C2H5OH)是以高粱、玉米、薯类等为原料,经过发酵、蒸馏制得,属于可再生资源。乙醇在足量的氧气中完全燃烧时生成二氧化碳和水,如果氧气不足,乙醇燃烧可能还有一氧化碳生成。现用下图实验装置进行实验,检验乙醇的燃烧产物中是否有二氧化碳和一氧化碳:(提示:CO+CuO
20、(6分)乙醇(C2H5OH)是以高粱、玉米、薯类等为原料,经过发酵、蒸馏制得,属于可再生资源。乙醇在足量的氧气中完全燃烧时生成二氧化碳和水,如果氧气不足,乙醇燃烧可能还有一氧化碳生成。现用下图实验装置进行实验,检验乙醇的燃烧产物中是否有二氧化碳和一氧化碳:(提示:CO+CuO![]() CO2+Cu)
CO2+Cu)
请回答下列问题:
(1)写出乙醇在足量的氧气中完全燃烧的化学方程式 。
(2)有甲、乙、丙三个同学分别完成上述实验并将观察到的现象填写在下表中,试用“有”、“没有”和“可能有”填写下表中的实验结论。
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 石灰水变浑浊 | 石灰水没变浑浊 | 石灰水没变浑浊 | 有 | |
| 乙同学 | 石灰水变浑浊 | 石灰水变浑浊 | 石灰水变浑浊 | ||
| 丙同学 | 石灰水没变浑浊 | 石灰水没变浑浊 | 石灰水变浑浊 | 有 | |
(3)若燃烧一定量的乙醇,得到4.4g二氧化碳和5.6g一氧化碳,在该反应过程中生成水的质量是 。
21、(6分)许多在水溶液的反应(如复分解反应),往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象。下表为相同温度下某些物质的溶解度:
| 物质 | AgCl (白色) | Ag2S (黑色) | CaSO4 (白色) | Ca(OH)2 (白色) | Ca(HCO3)2 (白色) | CaCO3 (白色) | NH4HCO3 无色透明 | (NH4)2SO4 无色透明 |
| 溶解度/g | 1.5 | 1.3 | 0.2 | 0.165 | 16.6 | 0.0015 | 21 | 75.4 |
(1)若在含有氯化银固体的水中加入硫化钠溶液,可能发生的现象是 。
(2)生产硫酸铵化肥的方法之一是:把石膏(CaSO4•2H2O)粉悬浮于水中,不断通入氨气再通入二氧化碳,充分反应后,立即过滤,滤液经蒸发而得到硫酸铵晶体。该反应的化学方程式为 。
(3)从上表中寻找两种能够按照上述规律相互转化的物质,写出实现该转化的化学方程式。 。
三、实验与推断题(本题包括4小题,共26分)
22、(4分)实验小组的同学为探讨过氧化钠(Na2O2)与二氧化碳的反应,用如下图所示的装置进行实验。通入CO2气体,将带火星的木条插入试管C中,木条复燃。
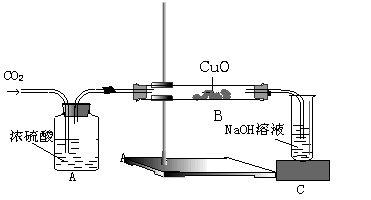
请回答下列问题:
(1) 根据木条复燃的情况,推测Na2O2与CO2发生的反应,写出化学方程式
。
(2) 请设计一种实验方案验证该反应的另一种产物
。
23、(7分)18世纪70年代,瑞典化学家舍勒首先发现并制得了氯气(Cl2)。氯气是一种黄绿色、密度比空气大且有毒的气体,它能与水发生化学反应声成盐酸和次氯酸(HClO)。氯气也能与碱溶液发生化学反应。
(1)实验室制取Cl2时,常用氢氧化钠吸收多余的氯气,防止氯气污染空气,请写出氯气和氢氧化钠溶液反应的化学方程式: 。
(2)自来水厂经常用氯气作消毒剂。目前市场上出售的某些假冒“纯净水”是由自来水灌装的,请你利用所学的化学知识加以鉴别,并写出有关的化学方程式:
。
(3)次氯酸具有漂白性,它可以将某些有色物质氧化成无色物质。某同学用滴管将饱和氯水(氯气的水溶液)逐滴滴入含有酚酞试液的的氢氧化钠溶液中,当滴到最后一滴时,红色突然褪去。红色褪去的原因可能有两种情况(用简要的文字说明):① 。② 。
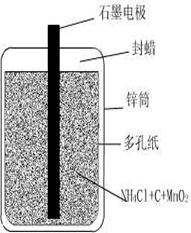 24、(9分)日常用的干电池构造、组成如图。
24、(9分)日常用的干电池构造、组成如图。
某校化学活动小组正进行的研究性课题是
《回收电池,变废为宝,保护环境-----用锌皮
制ZnSO4晶体》,请你和他们一道完成下列报告:
研究目的(1) 。
(3) 。
(一) 用锌皮制ZnSO4晶体
实验用品: 。
实验原理(写出化学方程式):
。
实验步骤(简述):
(1) 。
(2) 。
(3) 。
(二) 在仅除去了可溶物而回收的干电池的固体物质中除了MnO2外,还含有什么物质,若用这样的MnO2作KClO3热分解制氧气的催化剂会发生什么后果?
25、(6分)一些盐从溶液中析出时,往往含有结晶水,含有结晶水的盐称为水合盐,如
CuSO4•5H2O。下图表示某种盐的制备步骤:
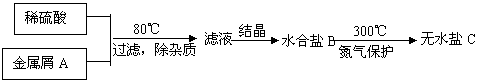 |
已知:水合盐B含有45.3%的水:无水盐C焙烧分解,放出两种无色刺激性气体E和F,并生成红棕色固体D。F与水生成硫酸。
请写出物质的化学式或名称:
A ,B ,C ,D ,E ,F 。
四、计算题(本题包括3个小题,共18分)
26、(6分)在无土栽培中,配制一定量含2.675KgNH4Cl、1.192KgKCl和4.176Kg
K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的质量依次是 Kg, Kg, Kg。
27、(6分)将含有不溶性物质的硝酸钾固体的混合物放入一定量的水中充分搅拌,得到的实验数据如表1;硝酸钾在不同温度时的溶解度如表2:
表1:
| 温度/℃ | 20 | 40 | 60 |
| 剩余固体质量/g | 136.8 | 72.2 | 20 |
表2:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
试计算:(1)原固体混合物中硝酸钾的质量是 g。
(2)加入水的质量是 g。
28、(6分)为了实现对海水中的氯化物(以NaCl计)进行成分分析,甲、乙、丙三位同学分别进行实验,他们的实验数据如下表,请分析数据回答下列问题:
| 甲 | 乙 | 丙 | |
| 所取海水质量/g | 100 | 50 | 50 |
| 加入AgNO3的质量/g | 50 | 50 | 75 |
| 反应后所得沉淀物质量/g | 1.435 | 1.435 | 1.435 |
(1)两种溶液完全反应的是 的实验。
(2)计算该海水样品中氯元素的质量分数(计算结果精确到0.1‰)
(3)若海水的密度以1g/cm3计,那么生产100吨精制食盐,至少需要多少立方米的海水?(精确到小数点以后的第一位)
2005年全国初中化学素质和实验能力竞赛答案
一、选择题
1、A 2、AC 3、AB 4、C 5、D 6、C 7、B 8、AB 9、D 10、AD 11、AB 12、A 13、A 14、D15、C 16、B
二、填空与简答题
17、导管B中的水面上升。(2)分 因为H2分子的相对分子质量小,运动快,单位时间里进入素烧瓷筒中逸出N2、O2分子数多,导致广口瓶C中气体的压力增大,将水压入玻璃导管B中。(2)分
18、FeCl2+H2=Fe+2HCl
19、CO2+2H2+C+2H2O 0.18
20、(1)C2H5OH+3O2=2CO2+3H2O
(2)(每空1分,共4分)
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 没有 | ||||
| 乙同学 | 有 | 可能有 | |||
| 丙同学 | 没有 | ||||
(3)8.1g
21、(1)白色的AgCl固体表面逐渐变黑,最终转变为黑色沉淀。
(2)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
(3)Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O
三、实验与推断题
22、(1)2Na2O2+2CO2=2Na2CO3+O2↑(2)分
(2)取白色故意,加希硫酸,产生能使澄清石灰水边混浊的气体,证明推测式正确的;反之,推论不正确。(2)分
23、(1)2NaOH+Cl2=NaCl+NaClO+H2O(2)分
(2)去少量水样至于试管中,往其中逐滴加入AgNO3溶液,若有白色沉淀生成,则证明水养中含有较多的Cl,该罐装水不是纯净水。(1分 )AgNO3+HCl=AgCl↓+HNO3 (2分)
(3)一种可能是:溶液中的红色物质被氯水中的次氯酸氧化褪色;另一种可能是:氯水肿的盐酸,次氯酸中和了氢氧化钠,使溶液由碱性转变成了中性甚至酸性,酚酞试液中性或酸性溶液中显无色。(2分 )
24、研究目的:(2分)
(1) 回收旧电池、人士滇池的组成与构造,了解废旧电池回收利用的方法。
(2) 学习用废金属锌制取硫酸锌晶体的方法,练习蒸发结晶和过滤的操作方法。
用锌皮制取硫酸锌的实验用品:废旧电池的锌皮、稀硫酸、小烧杯、蒸发皿、玻璃棒、酒精灯、铁架台(带铁夹、铁圈)、漏斗、滤纸等(写出必需的药品、仪器六种以上即可得2分)
制去硫酸锌的实验原理:Zn+H2SO4=ZnSO4+H2↑
制取硫酸锌的试验步骤:(写出主要步骤即可得3分)
(1) 拨开废旧电池,将有关表皮、技术锌皮,石墨碳棒、金属铜帽、黑色糊状物等分类放置。
(2) 将锌皮投入盛有稀硫酸的小烧杯,搅拌,使之完全溶解。
(3) 将上述溶液转入蒸发皿中加热蒸发至有大量晶体析出后,停止加热,趁热过滤,屡出的晶体用少量蒸馏水小心冲洗干净,即得硫酸锌晶体。
(二) 可能会引发爆炸,因为还有一些碳单质留在混合物中,加热条件下与氯酸家伙氯酸钾分解生成的氧气,易剧烈燃烧,产生的热量和气体不能及时排出,就会引起爆炸. 25、(6)分 A.Fe B.FeSO4••7H2O C.FeSO4 D.Fe2O3 E.SO2 F.SO3(每空1分,共6分)
四、计算题
26、(6分 )4.768、0.107、3.168
27、(6分 )(1)180g (2)200g
28、(6分 )(每问2分) (1)乙
(2)氯元素的质量分数=![]() =0.71%
=0.71%
(3)需要海水的体积=![]() =8547.01m3
=8547.01m3