初三第一次质量检测化学试卷
本试卷分试卷Ⅰ(选择题)和试卷Ⅱ(非选择题)两部分。试卷Ⅰ为第1页至第4页,试卷Ⅱ为第5页至第8页。考试结束后,将试卷Ⅱ和答题卡一并交回。
请认真阅读下列资料,解题时可能用到
(1)物质的溶解性表
| OH- | NO3- | Cl- | SO42- | CO32- | |
| NH4+ | 溶、挥 | 溶 | 溶 | 溶 | 溶 |
| K+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 溶 | 微溶 | 不溶 |
| Mg2+ | 不溶 | 溶 | 溶 | 溶 | 微溶 |
| Fe3+ | 不溶 | 溶 | 溶 | 溶 | 遇水易分解 |
| Cu2+ | 不溶 | 溶 | 溶 | 溶 | 不溶 |
| Ag+ | 易分解 | 溶 | 不溶 | 微溶 | 不溶 |
(2)在上述不溶物质中AgCl、BaSO4不溶于硝酸。
试卷Ⅰ(选择题,共25分)
注意事项: 1.答题前务必将姓名、准考证号、科目填涂在答题卡上。
2.选出答案后,请用2B铅笔将对应题目的答案标号涂黑,答在试卷上无效。
一、选择题(本大题共15小题,每小题1分,共15分。每小题只有一个选项符合题意)
1、生活中的许多变化都能产生热量,下列放热现象主要由物理变化引起的是
A.蜡烛燃烧时放出大量的热量 B.氢氧化钠与盐酸混合放出大量的热
C.白炽灯泡通电后发热 D.苹果腐烂时发热
2、下列实验操作不正确的是
A. B. C. D.
3、食品安全问题令人非常关注。下列食物不会危害人体健康的是
A.霉变的花生和大米 B.用鲜牛奶制成的酸奶
C.用甲醛浸泡的海产品 D.用工业用盐(NaNO2)腌制的泡菜
4、根据你的生活经验和所学知识判断下列说法,错误的是
A.缺乏维生素A,会引起夜盲症 B.食品包装中用一小袋生石灰做干燥剂
C.聚乙烯塑料可以制成食品保鲜袋 D.缺钙会引起甲状腺肿大
5、市场上有一种加酶洗衣粉,衣物上的汗渍、血迹及人体排放的蛋白质油渍遇到这种加酶洗衣粉都能被分解而除去。下列衣料:①羊毛织品;②棉织品;③化纤布料;④蚕丝织品。其中不宜用加酶洗衣粉洗涤的是
A. ①② B. ③④ C. ①④ D. ②③
6、金属元素与人体健康有很大关系。钾元素可以调节体液平衡,维持肌肉和神经功能及代谢。如果人体缺乏钾会出现肌肉不发达、心率不齐等症状。市场上出售的一种叫果味钾的补钾药,其主要成分是柠檬酸钾(C6H5K3O7·H2O)。下列有关柠檬酸钾的说法正确的是
(相对原子质量:H∶1 C∶12 O∶16 K∶39 )
A.该物质每个分子中有25个原子
B.该物质是由碳、氢、氧元素组成的
C.该物质是由原子直接构成的
D.该物质中碳、氢、钾、氧原子个数为6:7:3:8
7、诗句“春蚕到死丝方尽、蜡烛成灰泪始干”中蕴含着许多化学含义,下列说法错误的是
A.诗句寓意着发生了化学变化
B.诗句中“丝”含有的物质是蛋白质
C. 诗句中“泪”是指蜡烛燃烧产生的水
D. 诗句中“灰”是指蜡烛燃烧产生的二氧化碳、一氧化碳以及少量炭粒
8、农村有名谚语“雷雨发庄稼”,这是由于在放电条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐,雷雨给庄稼施加了 ( )
A、钾肥 B、磷肥 C、氮肥 D、复合肥
9、小红为妈妈设计了一份午餐食谱:米饭、清炖牛肉、麻辣豆腐。这个食谱营养不够全面,加上下列选项中的一项后能使之合理。这一项是
A、牛奶 B、素炒豆角 C、 鸡蛋羹 D、小米粥
10、下图是身边一些常见物质的pH,下列说法中不正确的是
 |
A、可用醋去除皮蛋的涩味 B、厨房清洁剂能使紫色石蕊试液变蓝
C、草木灰可用于改良酸性土壤 D、西瓜的酸性比苹果的酸性强
11、室温下,向一定质量的NaCl溶液中加入10gNaCl固体,充分搅拌后,尚有部分固体未溶解,再加入10g水后,剩余固体全部溶解。下列判断正确的是
A、加水前一定是饱和溶液 B、 加水前可能是饱和溶液
C、加水后一定是饱和溶液 D、 加NaCl固体前可能是饱和溶液
12.从石灰浆抹的墙壁上掉下的一块白色固体,为探究其成分,进行如下实验:
| 实验步骤 | 实验现象 |
| ①将固体磨成粉末状,加水搅拌 | 固体没有全部溶解 |
| ②取上层清液,滴加酚酞试液 | 溶液呈红色 |
| ③取不溶物,滴加稀盐酸 | 有气泡产生 |
由此得出的结论正确的是
A、一定含有Ca(OH)2,可能有CaCO3 B、一定含有CaCO3和Ca(OH)2
C、一定没有CaCO3和Ca(OH)2 D、一定有CaCO3,可能有Ca(OH)2
13、配制10%的氯化钠溶液时,不会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量取水时仰视读数 B.配制溶液的烧杯用少量蒸馏水润洗
C. 转移已配好的溶液时,有少量溶液溅出 D. 氯化钠晶体不纯
14、下列分离混合物的方法中,所依椐的原理不正确的是
| 选项 | 混合物的分离 | 分离物质的原理 |
| A. | 分离制氧气后剩余固体中的二氧化锰和氯化钾 | 二氧化锰和氯化钾的溶解性不同 |
| B. | 将石油加热炼制得到汽油、煤油、柴油等产品 | 石油中各成分的沸点不同 |
| C. | 分离硝酸钾和氯化钠组成的混合物 | 溶解度受温度影响不同 |
| D. | 分离液态空气制取氧气 | 利用氮气和氧气的密度不同 |
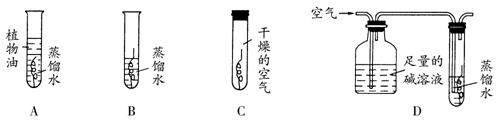
15、已知金属X、Y锈蚀物的化学式分别为X2(OH)2CO3、Y2O3·nH2O。则某学生设计的实验装置不能使X锈蚀,但能使Y锈蚀的是(试管内螺旋状物为金属X或Y)
二、选择题:以下各题,有一个或二个适合要求的答案。错选、多选不给分。有二个答案的,只选一个且正确,给1分。(每题2分,本题共10分)
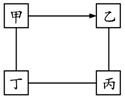 16.下图中“—”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以直接转化为乙。下面四组选项中,符合下图要求的是
16.下图中“—”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以直接转化为乙。下面四组选项中,符合下图要求的是
| 甲 | 乙 | 丙 | 丁 | |
| A | H2SO4 | NaOH | NaCl | Na2CO3 |
| B | CO | CO2 | H2SO4 | CuO |
| C | Zn | ZnSO4 | Mg | HCl |
| D | O2 | CO | CuO | C |
17.某化学反应的方程式为 mA + nB = aM + bN,则下列说法正确的是
A. 化学计量数m与n的比一定等于a与b的比
B. 若M是单质、N为化合物,则A和B中一定有一种是单质,一种是化合物
C.若B是酸,则M和N一定有一种是盐
D.若M和N中一种是盐,一种是水,则A和B中一种是酸,一种是碱
18.某同学对下列四个实验都设计了两种方案,其中第一方案比第二方案更方便、合理的是
|
| A | B | C | D |
| 实验要求 | 除去二氧化碳中 少量的氧气 | 清洗金属 表面油污 | 检验生石灰中 是否含有石灰石 | 区分硬水 和蒸馏水 |
| 第一方案 | 通过灼热炭粉 | 用洗洁精洗涤 | 加热 | 蒸发结晶 |
| 第二方案 | 通过灼热铜丝网 | 用水洗涤 | 滴加醋酸 | 加肥皂水 |
 19.有四瓶失去标签的溶液:①NaOH溶液②CuSO4溶液③Mg(NO3)2溶液④NaCl溶液,不另加其他试剂,则被鉴别出来的顺序为
19.有四瓶失去标签的溶液:①NaOH溶液②CuSO4溶液③Mg(NO3)2溶液④NaCl溶液,不另加其他试剂,则被鉴别出来的顺序为
A、②①③④ B、①②③④
C、②③①④ D、②①④③
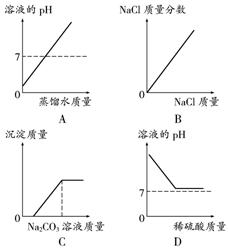
20.下列四个示意图分别表示对应的四种操作过程,其中正确的是
A、向一定量的稀盐酸中不断滴入蒸馏水
B、在恒定温度下,向一定量的水中不断加入氯化钠固体
C、向一定量的硝酸和硝酸钙混合溶液中不断滴入碳酸钠溶液
D、向一定量氢氧化钠溶液中不断滴入稀硫酸
请将选择题答案填入下表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
试卷Ⅱ(非选择题,共55分)
三、填空题:(共33分)
21、填写下列表格(6分):
| (1) | (2) | |||||
| 化学符号 | H | 2P2O5 | Al3+ | |||
| 名称或意义(只写一种) | 2个铁原子 | 由3个氧原子构成的一个臭氧分子 | 一氧化碳中碳元素显+2价 | |||
22、(10分)食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。
(1)下表是某市场销售的一种“加碘食盐”包装袋上的部分文字说明:
| 配料 | 含碘(I)量 | 保质期 | 食用方法 | 贮藏指南 |
| 氯化钠、碘酸钾 | 20mg~40mg/kg | 18个月 | 勿长时间炖炒 | 避热、避光、密封 |
(相对原子质量: O∶16 K∶39 I∶127)
 请回答:①已知碘酸钾的化学式为KIO3,则碘的化合价为________。
请回答:①已知碘酸钾的化学式为KIO3,则碘的化合价为________。
②上述“含碘量”中的碘是指__________(填序号)。
A、碘酸钾 B、碘元素 C、碘单质 D、碘分子
③由上述“文字说明”可推测碘酸钾的一种化学性质是___________。
④碘酸钾中碘的质量分数为__________,上述“加碘食盐”1000g中含碘酸钾的最低质量为__________mg(保留一位小数)。
(2)右图是病人输液时用的一瓶生理盐水标签,请根
据标签给出的数据计算:该生理盐水可为病人补充 g NaCl。常温下,一瓶合格的氯化钠注射液密封放置一段时间后,是否会出现浑浊现象?为什么?_______________________________________。
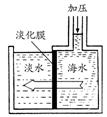 (3)①海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩。如图是采用膜分离技术的海水淡化装置,对右侧海水加压,经过一段时间后由右侧经高分子膜渗透得到淡水,加压前后,装置右侧海水的_________增加
(3)①海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩。如图是采用膜分离技术的海水淡化装置,对右侧海水加压,经过一段时间后由右侧经高分子膜渗透得到淡水,加压前后,装置右侧海水的_________增加
A、溶质的质量分数 B、溶剂质量 C、溶液质量 D、溶质质量
②分析高分子膜应具有的功能是 。
(4)已知:① 在化工生产中,原料往往不能全部转化成产品;② 工业上常用电解纯净的饱和食盐水的方法来得到烧碱溶液,再经过浓缩、蒸发等步骤制成固体烧碱。现要分析一种仓库里的固体烧碱样品。
① 猜测一下,该烧碱样品中可能含有哪些杂质。______________________。
②设计一个实验方案,来证实你的猜测是正确的。
| 实验步骤 | 实验现象 | 实验结论 |
23.(2分)右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
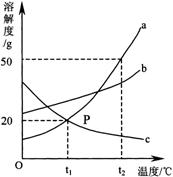 ⑴P点的含义是
。
⑴P点的含义是
。
⑵t2℃时30g a物质加入到50g水中不断搅拌,能形成80g
溶液吗? (填写“能”或“不能”)。
⑶t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列
是 (填写物质序号)。
⑷将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,
三种溶液的溶质质量分数大小关系是 (填
写选项序号)。
A.c>a=b B.a=b>c C.a>b>c D.b>a>c
 24.(2分)商场出售的服装都有面料成分说明标签。下图是某T恤衫标签上的部分文字:
24.(2分)商场出售的服装都有面料成分说明标签。下图是某T恤衫标签上的部分文字:
(1)面料成分中天然纤维是____ ____,合成纤维是 。
(2)检验布料在中含有羊绒的简单方法是_________________________________________。
25.(3分)小圆在一本参考书上发现,镁居然能在二氧化碳气体中燃烧!于是迫不及待的做起了这个实验:将镁条点燃后迅速伸入盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种白色粉末和一种黑色粉末。
⑴ 根据实验现象,我能写出该反应的化学方程式:_____________________________
⑵ 这个实验还引发了我对过去某些知识的反思,从而有些新的发现:
①__________________________________;②__________________________________。
26.(4分)某化工厂有甲、乙两个车间。它们排放的工业废水澄清透明,共含有Ag+、Cu2+、K+、NO3- 、Cl-、OH-六种离子。
(1)甲车间的废水含有3种离子,明显呈碱性,则甲车间废水中不可能存在的阳离子是___。
(2)乙车间的废水中含有另外3种离子,其中阴离子是_______。如果加足量的铁粉。可以回收的金属(填写元素符号)_____________。
(3)如果将甲车间和乙车间的废水按适当的比例混合,可以使废水中的某些离子转化为两种沉淀。经过滤后的废水主要含(填化学式)_______,可以用来浇灌农田。
27.(6分)如图所示,5种物质(或溶液中的溶质)A、B、C、D、E在一定条件下都可转变为F的溶液。已知A溶液为胆矾溶于水而得。请写出物质之间转化的化学方程式。
(1)黑色粉末D与某气体化合物反应生成红色金属E:_________________________________,该气体化合物在反应中起___________作用。
(2)红色金属E转化为溶液F:_______________________________,此反应在实际生产中的作用是_______________________________________________。
(3)蓝色溶液A转化为蓝绿色溶液B:_________________________________________。
(4)蓝色沉淀C转化为溶液F:___________________________________________。
(5)由蓝色溶液A转化为溶液F:___________________________________________。
四、科学探究题:(共22分)
28.(5分)下图所示为实验室常用的实验装置:
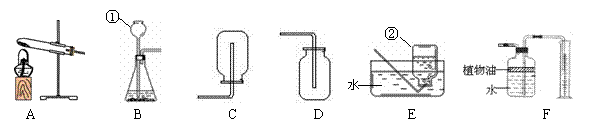
据此回答下列问题:
⑴写出带标号仪器的名称:① ② ;
⑵常温下,用锌和稀硫酸反应制取氢气,应选用的发生装置和收集装置分别是 (填序号,下同);
⑶实验室通常用稀盐酸和石灰石反应制取CO2,该反应的化学方程式为
;此外,CO2也可以用碳酸氢钠(NaHCO3)固体加热分解(产物为
碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为 ,若用此法来制取CO2,应选用的发生装置和收集装置分别是 ;
⑷F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是
,植物油上方原有的空气对实验的结果 (填“有”或“没有”)明显影响。
29.(5分)现有稀H2SO4、CuO、Fe粉3种物质,请设计两种制取铜的实验方案,填写下表:
| 实验方案 | 有关反应的化学方程式 |
| 方案一 | (1) (2) |
| 方案二 | (1) (2) |
两个方案相比,哪一个方案较好?其理由是(至少两条)_________________________________________、___________________________________。
30.(4分)硬水中含有较多的可溶性的钙、镁的化合物,其钙的化合物为Ca(HCO3)2,受热易分解,对其加热生成水和大量的气体,还有一种难溶性的盐,该盐是水垢的成分之一。
(1)[提出问题]探究Ca(HCO3)2受热分解的另外两种生成物。
(2)[猜想]①小刚认为生成物中的气体可能是二氧化碳;
②你认为生成物中的固体可能是__________,其猜想依据是__________________________。
(3)[设计实验方案]请你设计出简单的实验方案,来验证上述猜想是否正确。
(4)[现象与结论]如果小刚的猜想正确,其实验方案和现象应该是______________________________________________________;
如果你的猜想正确,其实验方案和现象应该是______________________________________。
(5)写出Ca(HCO3)2受热分解的化学方程式______________________________________。
31.(8分)某校化学研究性学习小组的同学对一包因敞口放置已部分变质的氢氧化钠产生了兴趣,想通过实验测定其中碳酸钠的质量分数,请你参与他们的探究过程。
【提出问题】:样品中碳酸钠的质量分数是多少?
【知识准备】:
(1)氢氧化钠不能敞口放置的原因是: ;
(2)判断氢氧化钠是否变质的方法之一是向样品中加盐酸,加入盐酸后发生的反应化学方程式是:________________________________、________________________________;
(3)判断氢氧化钠是否变质的另一种方法是将样品溶于水,再向样品中加澄清石灰水,看是否变浑浊,反应的化学方程式是:___________________________________________.
(4)向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应;
【设计方案】:
甲组同学:称取16.40g样品,放入足量的盐酸直到反应停止,共收集到4.40g二氧化碳。(设计思路:根据样品与盐酸反应生成二氧化碳的质量求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。)
乙组同学:称取16.40g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀10.00g。(设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。)
【解决问题】:
(1)乙组同学判断石灰水是否过量的方法是_____________________________________;
(2)根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:(请任选一位同学的实验结果进行计算)(相对原子质量:H∶1 C∶12 O∶16 Na∶23 Cl∶35.5 Ca∶40 )
甲组同学: 乙组同学:
初三化学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | D | C | D | C | A | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | B | C | D | D | CD | C | B | AD | C |
三.(本题共33分)
21.(每空1分,共6分)(合理答案皆可)(答案略)
22.(共10分)
(1)(前三空各0.5分,计算每空1分,共3.5分)
①+5,② B,③在受热或光照下不稳定、易分解。
④59.3%(1分),33.7(1分)。
(2)(共1.5分) 4.5g(1分)。不会出现浑浊现象。因为常温下,一瓶合格的氯化钠溶液,温度不改变、密封时水分不蒸发,氯化钠不会从溶液中分离出来。(0.5分)
(3)(共1分)①A ②能允许水分子透过,而不允许海水中的离子透过。
(4)(共4分)①(1分)NaCl、Na2CO3
②(3分)
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量固体,加水搅拌 | 固体溶解形成无色溶液 | |
| 取少许溶液,加入过量稀硝酸、振荡 | 有气泡产生 | 含有碳酸钠 |
| 在上述溶液中加入硝酸银溶液、振荡 | 有白色沉淀产生 | 含有氯化钠 |
23.(每空0.5分,共2分)
(1)在t1℃时,a、c两物质的溶解度相等,都等于20g。(2)不能。(3)cba、(4)D
24.(共2分)
(1)(1分)羊绒、棉;绦纶
(2)(1分)抽取少许面料丝,点燃,闻到有烧焦羽毛的气味。
25.(每空1分,共3分)
(1)2Mg+CO2点燃2MgO+C
(2)二氧化碳也能支持某些物质(如活泼金属)的燃烧;物质燃烧不一定需要氧气参加;二氧化碳可作灭火剂,但不能用于扑灭活泼金属引起的火灾。(合理答案皆可)
26.(每空1分,共4分)
(1)Ag+、Cu2+ (2)NO3- ;Ag、Cu; (3)KNO3
27.(共6分,作用每空0.5分,化学方程式每个1分)
(1)CuO+CO△CO2+Cu 还原
(2)2AgNO3+Cu=Cu(NO3)2+2Ag 湿法冶炼金属
(3)BaCl2+CuSO4=BaSO4↓+CuCl2
(4)Cu(OH)2+2HNO3===Cu(NO3)2+2H2O
(5)Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2
四.科学探究题(共22分)
28.(共5分)
(1)(1分)长颈漏斗,集气瓶
(2)(0.5分)B、(CE)
(3)(2.5分)CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaHCO3△Na2CO3+H2O+CO2↑ A、D
(4)(每空0.5分,共1分)防止二氧化碳溶解于水,引起实验的误差;没有。
29.(每个化学方程式1分,理由每个0.5分,共5分)
| 实验方案 | 有关反应的化学方程式 |
| 方案一 | (1)Fe+H2SO4=FeSO4+H2↑ (2)H2+CuO△Cu+H2O |
| 方案二 | (1)CuO+H2SO4=CuSO4+H2O (2)Fe+CuSO4=Cu +FeSO4 |
方案二较好。理由是①产生等量的铜,消耗Fe、H2SO4的量,方案一多;②方案一中氢气易燃易爆,实验不太安全;方案二的操作简易等。(合理答案皆可)
30.(共4分)
(2)(每空0.5分,共1分)CaCO3;化学反应前后元素的种类不变,且生成固体物质。
(4)(每空1分,共2分)将产生的气体通入澄清的石灰水中,澄清的石灰水变浑浊;在固体物质中加入稀盐酸,固体物质溶解,并产生能使澄清石灰水变浑浊的气体。
(5)(1分)Ca(HCO3)2△CaCO3↓+H2O+CO2↑
31.(共8分)
【知识准备】
(1)(1分)氢氧化钠固体不仅吸收空气中的水份,还能与空气中的二氧化碳反应而变质。
(2)(2分)NaOH+HCl=NaCl+H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑
(3)(1分)Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
【解决问题】
(1)(1分)取上层清液,向其中通入二氧化碳(或加入碳酸钠溶液),如变浑浊(有白色沉淀产生),表示石灰水己过量。
(2)(3分)甲同学:设样品中含有的碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.40g
106/x = 44/4.40g x=10.6g
样品中碳酸钠的质量分数为10.6g/16.40g×100℅= 64.6℅
答(略)
乙同学:设样品中含有的碳酸钠的质量为x
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
106 100
x 10.00g
106/x = 100/100.00g x= 10.6g
样品中碳酸钠的质量分数为10.6g/16.40g×100℅= 64.6℅
答(略)