中考化学全真模拟试题(四)
初三级 班 姓名: 学号:
试卷说明:1.考试时间100分钟,试卷满分100分。
2.可能用到的原子量:H—1,C—12,O—16,Na—23,S—32,Fe—56
一、选择题(每小题只有1个正确答案,共10分)
1.下列各式中,表示2个氢原子的是( )
A.2H B.H2 C.2H2 D.2H+
2.下列各物质中,属于氧化物的是( )
A.O2 B.HgO C.NaCl D.KMnO4
3.下列各物质发生的变化中,属于化学变化的是( )
A.水结成冰 B.将块状胆矾研成粉末
C.镁带燃烧 D.石蜡受热熔化
4.与元素的化学性质关系最密切的是该元素原子的( )
A.核电荷数 B.核内中子数
C.核外电子数 D.最外层电子数
5.下列电离方程式中,书写正确的是( )
A.BaCl2=Ba2++Cl-4 B.Ca(OH)2=Ca2++2OH-
C.H2SO4=2H++SO-24 D.Al2(SO4)3=2Al+3+3SO-24
6.下列各物质在氧气中燃烧中,能生成有刺激性气味气体的是( )
A.硫粉 B.一氧化碳 C.木炭 D.甲烷
7.下列各物质中,硫元素显示的化合价与SO2中硫元素的化合价相同的是( )
A.S B.H2S C.Na2SO3 D.NaHSO4
8.要除去N2中混有的少量H2、CO、CO2,得到干燥的N2(假设每步反应都是完全的),把混合气先后通过下列试剂,正确的顺序是( )
①浓H2SO4; ②NaOH溶液;③灼热的CuO。
A.①②③ B.③②① C.②①③ D.②③①
9.等质量的Na、Mg、Al、Fe4种金属,分别与足量的稀盐酸充分反应,产生氢气的质量由多到少的顺序是( )
A.Al,Na,Mg,Fe B.Al,Mg,Na,Fe
C.Na,Mg,Al,Fe D.Fe,Al,Mg,Na
10.有A、B、C、D4种物质,它们能发生如下反应:A+B→C+D,已知12克A与14克B恰好完全反应,生成18克C和一定量D。若要获得12克D,则参加反应的A的质量为( )
A.12克 B.14克 C.18克 D.15克
二、选择题(共10分,每小题有1~2个正确答案)
11.下列各说法中,正确的是( )
A.溶于水后能电离出氢离子和酸根离子的化合物叫做酸
B. 溶于水后水溶液能使酚酞试液变红的化合物叫做碱
C.固体苛性钠可以用来干燥二氧化硫等气体
D. 饱和溶液恒温蒸发掉一定量水后仍为饱和溶液
12.下列方法中,能将氧气和二氧化碳鉴别开的是( )
A.使两种气体分别通入紫色石蕊试液中
B. 使两种气体分别通过灼热的氧化铜
C.用一根燃着的细木条分别伸入两种气体中
D. 使两种气体分别通入浓硫酸中
13.将80℃的硝酸钾饱和溶液降温到20℃时,下列说法中,正确的是( )
A.溶液中溶质质量分数不变 B.溶液质量减少
C.溶液中溶质的溶解度减少 D.溶液变成不饱和溶液
14.下列制备CuCl2的方法中,正确的是( )
A.铜与稀盐酸反应 B.铜和稀H2SO4反应,再加稀HCl
C.氧化铜和稀盐酸以应 D.氢氧化铜和稀盐酸反应
15.已知某溶注中含有HCl、H2SO4和KNO3,则下列物质能存在于该溶液中的是( )
A.MgSO4 B.BaCl2 C.Na2SO3 D.NaOH
三、填空题(共35分)
16.空气中氧气和氮气的体积分数约为 %和 %。(1分)
17.元素是具有 的一类原子的总称。(1分)
18.保持二氧化碳化学性质的微粒是 ,1个氧气分子是由
成的。(1分)
19.某金属的硫酸盐化学式是Rm(SO4)N,则R的硝酸盐化学式是 ,若这种硫
盐式量为M,则R的相对原子质量是 。(2分)
20.在一定温度下,向100克质量分数为a%的某物质的水溶液中,加入w克该物质至完
全溶解,溶液恰好达到饱和。则此温度下,该物质的溶解度为 克,该饱和溶液中溶质的质量分数为 。(2分)
21.少量的氧化钙放入足量的水中,所得溶液俗称 ,该溶液的溶质
是 , 盛放它的试剂瓶内附有一层白色沉淀物,生成白色沉淀的化学方程式是
,除运河它所用的试剂是 ,反应方程式为
。(5分)
22.现有HCl、BaCl2、K2CO33瓶无色溶液,各取少许进行鉴别。若将甲和乙混合, 无色气体生成,乙和丙混合,无明显现象,判断甲为 ,乙为
,丙为 。(3分)
23.某土壤的pH值为4.5,这种土壤显 性,欲改良这种土壤,从Ca(OH)2、H3PO4、NaOH、NaCl中选用最佳的一种药品应是 。(2分)
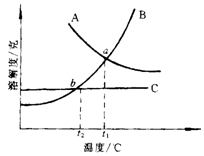
24.左图是A、B、C3种物质的溶解度曲线。
(1)a点说明A、B、C3种物质的溶解度在t1℃时 。
(2)当温度低于t2℃,A、B、C3种物质的溶解度大小关系为 ;
(3)当温度由t1℃降低到t2℃时,从B和C的饱和溶液中所得到的晶体的质量大小关系为 ;
(4)分离B和C的方法是 ;
(5)B质物的饱和溶液在t1℃质量分数为33.3%,则在t1℃时它的溶解度为
。(5分)
25.下表各物质都含有少量杂质,分别写出除去杂质应选用的物质及所发生的化学反应方式程式。(3分)
| 物质 | 杂质 | 除杂质选用的物质 | 发生反应的化学方程式 |
| 稀盐酸 | 稀H2SO4 | ||
| CO | CO2 | ||
| NaCl | Na2CO3 |
四、简答题(共22分)
26.实验室里做细铁丝在充满氧气的集气瓶中燃烧的实验时,能观察到的现象有:①
;② ;③ 。(每空1分,共3分)
27.有一个学生设计了一种证明某未知溶液中是否含有
上述方案能否证明未知溶液中一定含有![]() ?说明理由。
?说明理由。
。(共3分)
28.某固体粉末与KClO3混合共热,发现KClO3分解速率明显增大。由此得出粉末在该反应中(填“一定是”、“可能是”、“不是”) 催化剂。(1分)
29.冬天在室内生煤炉时,有时会发生煤气中毒的现象,这是因为炉中的煤燃烧
,生成了 的缘故。(2分)
30.根据物质的组成或结构不同,具体填写(1)~(6)组物质性质不同的原因。(6分)
(1)金刚石、石墨:碳原子 不同。
(2)钠原子和氧原子:原子的 不同。
(3)CO与CO2:分子的 不同。
(4)酸溶液、碱溶液:所含的 不同。
(5)生铁和钢: 不同。
(6)浓H2SO4+和稀H2SO4: 不同。
31.化学符号“Al”所表示的意义有: 。(3分)
五、实验题(共20分)
33.吸取药液后的滴管,不要 或 。(1分)
34.稀释浓H2SO4时,应将 沿着容器壁慢慢地注入 中。(1分)
35.用量筒量取液体时,量筒必须放平,视线要跟量筒内液体 保持水平,再读出体积数。(1分)
36.根据初中化学课本中学过的知识和实验内容,回答:
(1)使氧化铜还原为金属铜的气体有 。(1分)
(2)若用气体做还原剂,实验完成后停止加热,还要 ,直到试管冷却。(1分)
(3)某固体物质能使CuO还原,写出该固体物质与CuO反应的化学方程式
。(1分)
37.现有白纸及溶质质量分数分别为:(A)10%的NaOH溶液;(B)5%的H2SO4溶液;(C)5%的紫色石蕊试液。试设计《“雨”落叶出红花开》的趣味实验:先在白纸上用玻璃棒醮(填序号,下同) 画上花,再蘸 画上叶,将白纸挂上墙,用 向纸上喷洒即可。实验的化学原理是 (4分)
38.根据以下实验装置,回答问题。
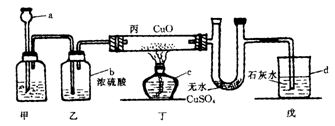
(1)写出a、b、c、d仪器的名称:
; b. ,c. ,d. 。(2分)
(2)甲容器中的固体若为锌粒,则它反应的化学方程式为 。丙装置中的实
验现象为 。丁装置中的实验现象为 。(4分)
(3)甲容器中的固体若为大理石,则它发生反应的化学方程式为
,乙容器的作用是 ,戊容器中的实验现象为
。(4分)
六、计算题(共13分)
39.用2 000千克含氧化铁75%的赤铁矿石最多能炼出铁多少千克?(3分)
40.有t℃时的某物质的饱和溶液200克,向其中加入50克水后,所得溶液中溶质的质量分数是多少?(t℃时该物质的溶解度为60克)(4分)
41.把27.5克NaOH与NaNO3的固体混合物加入到100克31.5%的HNO3溶液中,充分反应后,溶液的pH值正好为7,将所得溶液蒸发掉15克水后降温到10℃,正好形成饱和溶液,求:
(1)混合物中氢氧化钠的质量分数。
(2)若把蒸发掉水变成饱和溶液的措施变为加入溶质的方法,则在10℃时应加多少
克溶质?(6分)
中考化学全真模拟试题(四)参考答案
一、1.A 2.B 3.C. 4.D. 5.B 6.A 7.C 8.B 9.B 10.C
二、11.D 12.A、C 13.B、C 14.C、D 15.A
三、16.21,78
17.相同核电荷数(或核内质子数)
18.二氧化碳分子,2个氧原子
19.R![]() ,
,![]()
20.![]() ,
,![]() %
%
21.石灰水,Ca(OH2),Ca(OH2)+CO2=CaCO3↓+H2O,稀盐酸,CaCO3+2HCl=CaCl2+H2O+CO2↑
22.K2CO3,HCl,BaCl2
23.酸,Ca(OH)2
24.(1)相等 (2)B<C<A (3)B>C (4)冷却热饱和溶液 (5) 50克
25.BaCl2溶液,BaCl2+H2SO4=BaSO4↓+2HCl
NaOH[或Ca(OH)2等可溶性碱] ,2NaOH+CO2=Na2CO3+H2O
盐酸(或CaCl2、BaCl2溶液),Na2CO3+2HCl=2NaCl+H2O+CO2↑
四、26.①剧烈燃烧,火星四射 ②生成黑色固体物质 ③放出大量的热
27.不能。若未知溶液中有Ag+,也会出现同样的现象
28.可能是
29.不充分,CO
30.(1)排列 (2)最外层电子数 (3)构成 (4)离子 (5)含碳量(或含铁量) (6)H2SO4的质量分数
31.①铝单质 ②铝元素 ③1个铝原子
32.CaO+H2O=Ca(OH)2,Ca(OH)2+CO2=CaCO3↓+H2O
五、33.倒放,平放
34.浓H2SO4,水
![]() 35.凹液面的最低处
35.凹液面的最低处
36.(1)H2、CO (2)继续通入气体 (3)2CuO+C 2Cu+CO2↑
37.B.A,C,紫色石蕊试液遇酸变红,遇碱变蓝
38.(1)a.长颈漏斗 b.广口瓶(或洗气瓶) c.酒精灯 d.烧杯
(2)Zn+2HCl=ZnCl2+H2↑,黑色粉末逐渐变为亮红色,白色CuSO4粉末变成蓝色晶体
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑,干燥气体,澄清石灰水变浑浊
六、39.1 050千克
40.30%
41.(1)72.7% (2)12克