中考化学试卷(新课程卷)
一、选择题(每小题2分,共18分。每小题只有—个选项符合题意)
1.下列选项中,前者是化学变化,后者属于物理性质的是
A.食物腐败 钢铁生锈 B.干冰升华冰雪融化
C.氢气燃烧氧气五色 D.烧杯炸裂 火药爆炸
2.下列四种物质中是混合物的是
A.C60 B.冰水 C.硫粉 D.石油
3.以下四个选项中错误的是
A.氧原子的结构示意图为 B.Mg2+的结构示意图
C.原子是化学变化中最小的粒子 D.2Na+2H2O=2NaOH+H2↑此反应属于置换反应
4.下列说法中不正确的是
A.任意丢弃大量的塑料食品袋、塑料薄膜等不会造成“白色污染”
B.大气中CO2含量不断增加,会使温室效应增强,全球变暖
C.风能、太阳能、氢能源都属于绿色能源
D.碳铵与熟石灰混合施用会降低碳铵肥效
5.下列各组离子在溶液中能大量共存的一组是
A.Cl- Cu2+ Ag+ K+ B.SO42+ H+ Cl- Na+
C.Ca2+ K+ CO32- Cl- D.Ba2+ Cu2+ SO42- OH-
 6,四种金属M、N、R、Q同时在两个烧杯内的反应
6,四种金属M、N、R、Q同时在两个烧杯内的反应
情况可形象地用以下两幅卡通画表示(如图所
示).甲烧杯内卡通人周围的小黑点表示反应中
生成的气泡,且小黑点的多少表示反应的剧烈
程度.乙烧杯内卡通人周围封闭粗线表示覆盖
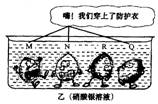 的金属,则四种金属的活动性由强到弱的顺
的金属,则四种金属的活动性由强到弱的顺
序为
A.N>M>Q>R
B.N>M>R>Q
C.M>N>Q>R
D.Q>R>N>M
7.a、b、c三种物质的溶解度曲线如图所示.根据此图,判断以下说
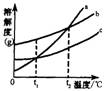 法中正确的一项是
法中正确的一项是
A.t2℃时,a、c两物质的溶解度相等
B.t1℃时,a、b、c三种物质的溶解度(用S表示)关系为Sa=Sb>Sc
C.a物质从溶液中析出,可采用冷却其热饱和溶液的方法
D.t2℃时,将a、b、c三种物质的饱和溶液降温,其质量分数都变大
8.在反应M+2N=R+2Q中,3.2gM与N恰好完全反应后,生成8.8gR,且反应生成的R和Q的质量比为11:9,则在此反应中N和Q的质量比是
A.16:11 B.16:9 C.9:16 D.4:9
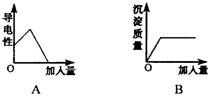
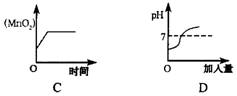
9.下列四种叙述均用图中所对应的图象表示,其中图象正确的是
①图象A表示向一定量的Ba(OH)2溶液中滴加CuSO4溶液,其导电性与加人量的关系
②图象B表示向一定量的Na2SO4溶液中滴加BaCl2溶液,沉淀量与加入量的关系
③图象C表示一定量的KMnO4加热制O2的过程中,残留固体中MnO2的质量分数与时间的关系
④图象D表示向一定量的NaOH溶液中逐渐滴加稀盐酸,溶液在变化过程中pH与加入量的关系
 |  | ||
二、填空题(每空1分,共6分)
10.(1)一氧化氮是新近发现的具有生物活性的小分子物质,在生命活动中起着重要的作用。一氧化氮的化学式是 。
(2)餐桌上的化学污染直接危及饮食安全。2001年1月10日浙江余杭市有63人因吃了含“瘦肉精。的猪肉而中毒。“瘦肉精”又称盐酸克伦特罗,其化学式为:C12H19Cl13N20,“瘦肉精”中含有 种元素。
(3)氯气(Cl2)和氧气一样,都是活泼的非金属单质。甲烷和氧气反应的化学方程式为:CH4+2O2![]() CO2+2H2O。在一定条件下,甲烷和充足的氯气可反应,请推测并写出甲烷和氯气反应的化学方程式:
。
CO2+2H2O。在一定条件下,甲烷和充足的氯气可反应,请推测并写出甲烷和氯气反应的化学方程式:
。
11.市场上销售的某饮料标签上有如下说明:
配料:纯净水、白砂糖、鲜橙浓缩汁、柠檬酸、维生素C、食用香精 鲜橙原汁含量≥10%
净含量:500mL
(1)某同学喝该饮料时,感觉该饮料有酸味,用pH试纸检测,其pH 7(填<、>或=),你认为主要是配料中的 使该饮料具有了酸味。
(2)黄瓜、西红柿等富含维生素C的蔬菜常用凉拌等方式加工(即不经高温处理)后食用或生吃,才能使其中的维生素C被较好利用。由此可看出,维生素C具有 的性质。
三、分析题(每空1分,共6分)
12.(1)1854年5月30日,英国战舰“欧罗巴”按照作战命令开始了远涉重洋的远航。它的船舱里结结实实地装满了供战马吃的草料,两个多月后,船舱突然冒出熊熊大火,大火迅速吞没了整艘战舰,片刻之间战舰便葬身海底,全舰官兵、战马无一生还。事后,化学家们根据军事保安部门提供的材料,准确地找到了“纵火犯”——草料。
请你作为一个化学家对草料成为。纵火犯”的原因进行分析.列举出用以解释其原因的主要概念 、 。(写出其中两个即可)
(2)世界卫生组织1989年正式将铝确定为食品污染物而加以控制。铝的有毒形态是Al3+,家庭使用铝制炊具(铝锅、铝铲、铝勺等)时,应注意 。
13.腌制皮蛋的化学配方有多种,传统的方法是将灰料敷在鲜蛋外,灰料的主要原料一般包括生石灰(CaO)、纯碱(Na2CO3)、草木灰(主要成分K2CO3)以及食盐等.用水调制灰料成浆糊状,敷于蛋上,密封保存,数天后即可食用。
(1)这些物质在水中可发生化学反应,请按要求各写出一个化学方程式.
放出大量的热
复分解反应
(2)腌制皮蛋后的浸出液中一定含有的溶质是(写化学式) 。
四、探究题(每空1分,共14分)
14.某课外活动小组从海边盐滩上获得了一定量的粗盐,欲进行粗盐提纯的探究活动.请你参与其中,完成探究活动中的有关问题。
(1)查阅资料
①粗盐中含有较多的可溶性杂质(MgCl2、CaCl2等)和不溶性杂质(泥沙等)。
②氯化钠在室温(20℃)时的溶解度为36.0g
③Mg2+、Ca2+的碱和盐的溶解性(20℃)
如下表:
|
| OH- | NO3- | SO42- | CO32- |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| Ca2+ | 微 | 溶 | 微 | 不 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水.
(2)实验方案设计与问题讨论
①溶解(20℃) 用托盘天平称取10.0g粗盐,用药匙将该粗盐逐渐加入到盛有10mL水的烧杯里,边加边搅拌,直到粗盐不再溶解为止.此时加入的粗盐质量至少是 g。
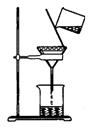 ②除杂 若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的
②除杂 若要除去粗盐中的可溶性杂质CaCl2,可向其中加入过量的
Na2CO3溶液;若要除去杂质MgCl2,可向其中加入过量的 溶液,
然后按如图所示装置进行 操作。再向滤液中加入适量的 即
得到氯化钠溶液。如果观察所得滤液是浑浊的,再过滤,仍浑浊,其可能
的原因是: 。
③蒸发
(3)实践 实验操作过程略。
15.草酸的化学式为H2C2O4,甲、乙两同学对草酸受热分解及其产物的检验做了探究.
(1)猜想与假设
 第一种:草酸分解产物是CO2和H2
第一种:草酸分解产物是CO2和H2
第二种:草酸分解产物是CO2、CO和H2O
第三种:草酸分解产物是CO2和H2O
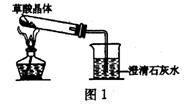
(2)实验装置的设计(图中铁架台略去)
甲同学设计了如图1所示的装置
乙同学设计了如图2所示的装置(图中无
水CuSO4是白色,遇水变蓝)
(3)实验
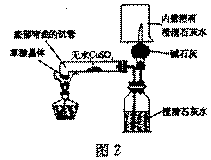 甲同学按图l装置实验,观察到澄清石灰
甲同学按图l装置实验,观察到澄清石灰
水变浑浊,……。
乙同学按图2装置实验,观察到澄清石灰
水变浑浊,证明产物中有 ;
无水CuSO4变蓝,证明产物中有水;证明产物中有
CO的化学方程式是: 。
(4)结论 第二种猜测是正确的,即H2C2O4
=CO2 ↑+CO↑+H2O
(5)反思与评价
乙同学认为甲同学设计的实验装置有缺陷:由于试管口向下倾斜,加之草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。
甲同学认为乙同学的设计是科学合理的。
请你谈谈图2装置优于图1装置之处:
(答出两点即可,你如果能答出第三点或更多,且正确,奖励1分,但第Ⅱ卷满分不超过32分)
第一点: 。
第二点: 。
第三点: 。
乙同学设计的图2装置也能证明产物中无H2,证明的方法是: 。
16,学校实验室开放,实验员用集气瓶和软质塑料瓶收集了数瓶氯化氢气体(足够同学们实验时
使用),置于实验台上,让同学们自由做实验。
请参考表中示例提出你想探究的有关氯化氢气体性质的两个问题,并叙述相应的实验方法。
| 提出问题 示例,干燥HCl气体的酸碱性如何? | 实验方法 示例:将一干燥的pH试纸放入盛HCl气体的集气瓶中,观察现象 |
| ①
②
| ①
②
|
五、计算题(共6分)
17.(1)曲酸(C6H6O4)是一种新型添加剂,它具有广泛的抗菌作用,作为防腐剂添加于食品中,具有非常好的效果.曲酸的相对分子质量是 ,曲酸中碳、氢、氧三种元素的质量比是 ,
(2)某工厂的废料中含铁和铜,需回收此废料中的铜.现取铁和铜的混合物样品l0g,向其中加入废弃的稀硫酸50g恰好完全反应,产生0.1gH2。
求:①废料中铜的质量分数。
②废弃稀硫酸中硫酸的质量分数。
参考答案
1~5 CDAAB 6~9 CCBB
10.(1)NO (2)五 (3)CH4+4Cl2=CO2+4HCl
11.(1)<;柠檬酸 (2)高温下不稳定
12.(1)缓慢氧化;着火点;自燃。
(2)尽量避免铝制炊具与酸性物质接触或不能长时间用铝锅盛装酸性食物。
13.(1)CaO+H2O=Ca(OH)2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
或K2CO3+Ca(OH)2=CaCO3↓+2KOH (2)NaCl、NaOH、KOH
14.3.6g,NaOH;过滤;盐酸(或HCl);滤纸破损(或过滤液的液面高于滤纸边缘)
15.CO2 ; 2CO+O2![]() 2CO2;CO2+Ca(OH)2=CaCO3↓+H2O
2CO2;CO2+Ca(OH)2=CaCO3↓+H2O
第一点:底部弯曲的试管避免了熔化的草酸流进导管。
第二点:乙同学设计的装置可同时证明CO2、CO、H2O的存在。
第三点;乙同学的设计在验证了CO存在的同时又解决了CO的污染问题。
第四点:乙同学的设计可证明H2不存在。在球形干燥管的尖嘴处点燃通过碱石灰干燥后导
出的气体(或点燃尖嘴处的气体),并在火焰上方罩一冷而干燥的小烧杯,烧杯内壁无水雾,证明无H2。
16.(1)HCl气体是否溶于水;向软质塑料瓶中注入约1/2的水,看塑料瓶是否变瘪
(2)HCl水溶液的酸碱性;用pH试纸或酸碱指示剂检验
(3)HCl气体与NaOH溶液能否反应,将滴有酚酞试液的NaOH溶液倒人盛HCl气体的瓶中
(4)HCl气体能否与AgNO3溶液反应;将AgNO3溶液滴入HCl气体中
17.(1)142;36:3:32(或72:6:64)
(2)解:设废料中铁的质量为x,稀硫酸中H2SO4的质量为y
Fe+H2SO4=FeSO4+H2↑
56 98 2
x y 0.1g
![]() x=2.8g
x=2.8g
![]() y=4.9g
y=4.9g
铜的质量分数为: ![]() =72%
=72%
稀硫酸的质量分数为: ![]() 9.8%
9.8%
答;略