初三第一次质量检测化学试卷
说明:
1.本次考试化学试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分。共80分。考试时间100分钟。
2.请用2B铅笔将第Ⅰ卷(选择题)的答案填写在答题卡上。答第Ⅱ卷时,用钢笔或圆珠笔(蓝色或黑色)将答案直接写在试卷上。
第Ⅰ卷(选择题 共25分)
一、选择题:以下各题,只有一个符合要求的答案。(每题1分,本题共15分)
1. 物质的下列性质中属于物理性质的是
A.可燃性 B. 酸碱性 C.氧化性 D. 挥发性
2.下图所示变化属于化学变化的是
 |
A.对玻片呼气 B.蜡烛燃烧 C.湿衣晾干 D.灯泡通电发光
3.我们身边常见的下列物质中,属于氧化物的是
A.氧气 B.水 C.空气 D.食盐
4.保持氢气化学性质的微粒是
A.H B.H2O C. H2 D. 2H
5. 将下列物质放在盛有水的烧杯中,用玻璃棒搅拌,不能形成溶液的是
A.蔗糖 B.食盐 C.纯碱 D.冰块
6. 下列图示实验操作正确的是
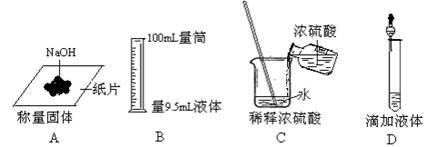
7.下列关于NaNO3 、 Na2O2 、 SO2 、O2等四种物质的组成的叙述中正确的是
A.都含有氧气 B.都含有氧元素
C.都含有氧原子 D.都含有2个氧原子
8. 区分下列常见的各组物质时,所用方法错误的是
A.硬水和软水——加肥皂水振荡
B.食盐和小苏打(NaHCO3)——滴加醋酸
C.一氧化碳和甲烷——点燃后观其火焰颜色
D. 毛织品和棉织品——燃烧后闻气味
9. 锰和镍(Ni)都是金属。现将镍丝插入硫酸锰溶液中,无变化;插入硫酸铜溶液中,镍丝上有铜析出。Mn、 Ni 、Cu的活泼性顺序是
A.Mn、 Ni 、Cu B. Cu、 Ni 、Mn
C. Cu、Mn、 Ni D. Ni 、Mn、 Cu
10.有机合成材料的出现是材料发展史上的一次重大突破。下列物质属于有机合成材料的是
A.棉花 B.蛋白质 C.维生素 D.塑料
|
![]()
![]() A. 表面皿内壁有浑浊出现
A. 表面皿内壁有浑浊出现
|
![]()
|
![]() D.贝壳逐渐溶解
D.贝壳逐渐溶解
12.某化合物R与水和氧气发生化学反应为:2R + 2H2O+7O2 = 2FeSO4 + 2H2SO4,推断R的化学式为
A.FeS B.Fe2S3 C.FeO D.FeS2
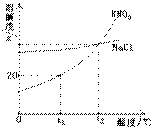 13. 右图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
13. 右图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度不受温度的影响
B.t1℃时, KNO3饱和溶液中溶质的质量分数
是20%
C.t2℃时,NaCl饱和溶液与KNO3饱和溶液中,
溶质的质量分数不一定相等
D.在温度高于t2℃范围内,KNO3的溶解度始终
大于NaCl的溶解度
14.下列各组气体中,、均能用固体氢氧化钠干燥的一组是
A. CH4 、CO2 、 CO B.H2 、O2 、 HCl
C. H2 、O2 、CO D.O2 、 CO 、 SO2
15.传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日爆晒蒸发醋中的水分,以提高醋的品质。假设用醋酸的质量分数为3%的半成醋,生产500g 5.4%的优质醋,过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为
A.500g B.400g C.200g D.100g
二、选择题:以下各题,有一个或两个符合要求的答案,错选,多选不给分。有两个答案的,只选一个且正确的,给1分。(每题2分,本题共10分)
16.下列化学用语与含义相符的是
+3
A.Al——1个铝离子带3个单位的正电荷 B. 2H——1个氢分子由2个氢原子构成
C. 2H2O——2个水分子 D.Na+——钠元素的化合价为+1价
17.下列化学反应中,符合右图卡通画情景的是
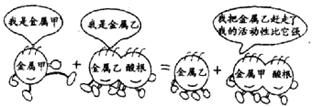
|
![]()
![]() A.C+2CuO 2Cu+CO2↑ B.Cu+2AgNO3
Cu(NO3)2+2Ag
A.C+2CuO 2Cu+CO2↑ B.Cu+2AgNO3
Cu(NO3)2+2Ag
![]() C.H2 + CuO
C.H2 + CuO ![]() H2O
+Cu
D.Zn+H2SO4
ZnSO4+H2↑
H2O
+Cu
D.Zn+H2SO4
ZnSO4+H2↑
18.除去下表中各物质(A~C为溶液)中的少量杂质,所选用的试剂、方法正确的是
| 编号 | 物质 | 杂质(少量) | 试 剂 | 除杂操作方法 |
| A | NaCl | CaCl2 | 过量Na2CO3溶液 | 过滤 |
| B | KNO3 | NaCl | / | 冷却热饱和溶液,过滤 |
| C | FeSO4 | CuSO4 | 过量铝粉 | 过滤 |
| D | CO2 | CO | / | 点燃 |
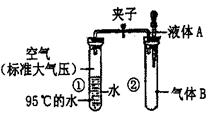 19. 如右图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
19. 如右图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.氢氧化钾溶液、氯化氢
C.酒精、氧气
D.水、一氧化碳
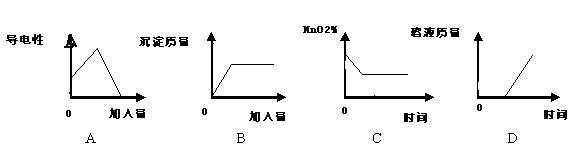
20.下列四种变化均用所对应的图像表示,其中图像正确的是
①图像A表示向一定量的Ba(OH)2溶液中滴加CuSO4溶液,导电性与加入量的关系
②图像B表示向一定量的Na2SO4溶液中滴加BaCl2溶液,沉淀量与加入量的关系
③图像C表示一定量的KMnO4加热制O2的过程中,残留固体中MnO2的质量分数与时间的关系
④图像D表示一定量稀硫酸与锌粒反应,溶液的质量与反应时间的关系
第Ⅱ卷 ( 共55分)
三.(共22分)
21.(4分)从H、O、C、N、Na、Cu六种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(每空只填一种物质)。
(1) 最轻的气体 ;(2)厨房用的酸性调味品是 ;
(3) 发面时用的口碱晶体 ;(4) 相对分子质量最小的氧化物是 ;(5) 能作燃料的是(写出两种) 、 ;
(6)农业上作为氮肥的是 ;(7)游泳池中的蓝色物质是 。
22.(2分)甘油在印刷、化妆品等工业中常用作润湿剂,也可用来制造医药和炸药。根据甘油的化学式C3H8O3,你能得出哪些信息?(任写两条)
① ;② ;
 23.(2分)根据下列几种粒子的结构示意图,回答问题。
23.(2分)根据下列几种粒子的结构示意图,回答问题。
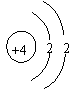 |  | 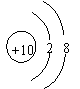 |
① ② ③ ④
(1)其中属于阳离子的是 (填序号,下同)
(2)具有相似化学性质的是
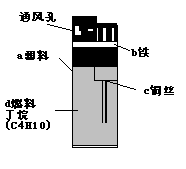 24.(2分)打火机给人们的生活带来了方便,右图是一种普通电子打火机的示意图。据图回答:
24.(2分)打火机给人们的生活带来了方便,右图是一种普通电子打火机的示意图。据图回答:
(1)属于单质的是 (选填一种物质的编号,下同),属于有机物的是 。
(2)打火机挡风罩通风孔的作用是使空气流通,据此说明燃烧需要的条件之一是 。
(3)用分子、原子的观点解释丁烷气体能被压缩成液体的原因 。
25.(8分)化学反应方程式是重要的化学用语,请将下列变化用化学反应方程式表示,在括号内注明反应的基本类型,并按照要求填写正确答案。
(1) 生石灰制熟石灰 ,( )反应
(2) 一氧化碳还原氧化铁 ,
(3) 铝和二氧化锰在高温条件下反应制造金属锰,同时生成另一种氧化物
,( )反应
(4)做化学实验时,不小心皮肤上沾上了硝酸银溶液,过一段时间会出现黑色痕迹,很难洗去,这是因为硝酸银见光分解生成一种金属、一种红棕色气体(NO2)和一种能供给呼吸的气体,请写出此反应的化学反应方程式 ;该反应的基本类型是 反应;该反应中氮元素在不同物质中所显化合价
(填“相同”或“不同”),所显化合价是 。
(5)反应条件在化学反应中起着重要的作用,反应物相同但条件不同,生成物可能不同。
①将二氧化碳通入水中,生成碳酸,为证明二氧化碳与水发生了反应,应加入的试剂是 。
②绿色植物通过光合使用,将二氧化碳和水合成为 ,同时生成的气体是 。
26.(4分)根据下表回答:
|
| OH- | NO3- | Cl- | SO42- | CO32- | ||||||
| H+ |
| 溶、挥 | 溶、挥 | 溶 | 溶、挥 | ||||||
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 | ||||||
| Ca2+ | 微溶 | 溶 | 溶 | 微溶 | 不溶 | ||||||
| Cu2+ | 不溶 | 溶 | 溶 | 溶 | 不溶 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不 溶 | 不 溶 | ||||||
| Zn2+ | 不溶 | 溶 | 溶 | 溶 | 不溶 |
(1) Zn(OH)2的溶解性 。
(2)从上表中找出一种微溶性盐 (填化学式,下同)。农业上常用来改良酸性土壤的一种碱是 .
(3) Zn(NO3)2 、BaCl2两种溶液能不能发生反应? (填:“能”或“不能”),理由是 .
(4) 完成硫酸和表中的一种可溶性盐反应的化学反应方程式:
四.(22分)
27.(2分)下列实验技能都是你必须具备的,你能做出正确回答吗?
(1)如何判断玻璃仪器已经洗涤干净?
(2)洒出的酒精在桌上燃烧起来,如何![]() 处理?
处理?
28.(9分)归纳与演绎是重要的科学方法,也是常用的化学学习方法。
(1)我们已经学习过实验室制取O![]() 2 、CO2 、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法。请你归纳出实验室制取气体反应的共同点
(填序号)
2 、CO2 、H2(Zn和稀硫酸反应)三种气体的反应原理、制取与收集方法。请你归纳出实验室制取气体反应的共同点
(填序号)
①需要加热 ②使用催化剂 ③没有气体参加反应 ④原料为纯净物 ⑤只生成一种气体
(2)下列是实验室常用的仪器
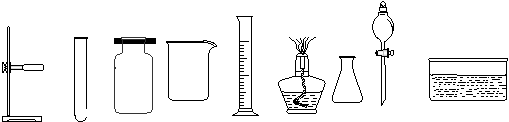
a b c d e f g h i
写出仪器名称:a是 ,c是 ;写出 d 的一种用途 。
(3)化学上可以通过多种反应制得NH3(极易溶于水,密度比空气小),例如
①2NH4Cl(固) + Ca(OH)2(固)![]() CaCl2
+ 2NH3↑ + 2H2O
CaCl2
+ 2NH3↑ + 2H2O
②NH4HCO3(固)![]() NH3↑ + CO2↑ + H2O
NH3↑ + CO2↑ + H2O
③CaO(固) + NH3.H2O(浓)==NH3↑ + Ca(OH)2
我将选择反应 (只写一个,填序号)作为实验室制取氨气的反应原理。我需要用上面仪器中的 (填序号)来装配氨气发生装置(连接装置已经省略),我采用的收集方法是 。我选择的发生装置还可以用来制取 气体。
(4)某研究小组对用双氧水分解生成水和氧气的实验条件进行探究,完成了以下实验:
①往盛有5 ml 5%H2O2溶液的试管中,伸入带火星的木条,木条不复燃。
②往盛有5 ml w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃。
③往盛有5 ml w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃。
④经检验,②③中反应后试管中仍分别含有a gMnO2和 ag Fe2O3
|
研究小组还对溶液浓度、催化剂的种类等实验条件进行探究。下表选取了部分实验数据:用足量等体积H2O2溶液制取相同体积O2所需要的时间
|
时间(min)
条件 | 30%H2O2 | 15%H2O2 |
5%H2O2 | ||
| a g MnO2 | 0.2 | 0.8 | 2.0 | ||
| ag Fe2O3 | 0.7 | 9.0 | 16.0 |
|
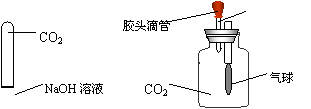
![]() A
B
A
B
(1) 请写出两种装置中可能发生的现象:A , B
(2) 为了进一步验证CO2与 NaOH溶液已经发生了反应并生成了新物质,请你来设计一个简单的实验,检验生成的新物质并书写下列实验报告。
| 实验步骤 | 实验现象 | 解释与 结论 |
30.(6分)小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%。小明想:这瓶白醋中醋酸的含量是否与标签的标注相符?请你用有关酸碱的知识,定量测定白醋中醋酸的含量。
【实验原理】(1)利用中和反应可以测定酸或碱溶液中溶质的质量分数。在一定量的待测酸或碱的溶液中逐滴加入已知质量分数的碱或酸溶液(即标准溶液)。直到酸碱正好完全反应。根据滴加的标准溶液的多少就可以求出待测酸或碱溶液的质量分数。
(3) 用已知浓度的氢氧化钠溶液(标准液)和醋酸反应,反应的化学方程式为:
CH3COOH + NaOH = CH3COONa + H2O
(3)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05 mL,对测定结果的影响很小,可忽略不计。
【实验步骤】①用量筒量取12.0 mL白醋(密度近似为1.0g/ mL),倒入烧杯中,加入20 mL蒸馏水稀释。
②量取45.0 mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0 g/ mL),用胶头滴管取该氢氧化钠溶液,逐滴地滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液。滴至恰好完全反应,剩余氢氧化钠溶液5.0 mL。
【交流反思】
(1)在实验步骤①中,加适量水稀释白醋,对实验结果有无影响?为什么?
答:
(2)在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?
答:
(3)下列曲线是每次测定过程中,溶液的pH随所滴加的NaOH溶液体积的变化而变化的关系图。则符合上述实验的图线是( )
![]()
![]()
![]()
![]()
![]() pH
pH
pH
pH
pH
pH
pH
pH
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 7
7
7
7
7
7
7
7
40 V/ml 45 V/ml 40 V/ml 45 V/ml
A B C D
【数据处理】
根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符?请写出计算过程。(可能用到的相对原子质量:H—1,C—12,O—16,Na—23)
五.(11分)
|
(1) 碳酸氢铵中氮、氢、氧、碳四种元素的
质量比 。
(2) 碳酸氢铵中氮元素的质量分数为 。
(3)每袋化肥中氮元素的质量 kg。
该广告是 (填“虚假”或“真实”)。
32.(5分)已知常用的强酸(盐酸、硫酸、硝酸)跟常用的强碱(氢氧化钠、氢氧化钾)反应生成的盐的水溶液显中性。现将某白色粉末A溶入某一无色中性液体中,按下图所示进行实验,试按下列要求推断未知物:(可以参照26题的溶解性表)

![]()
![]() 搅拌 加适量B溶液,恰好
搅拌 加适量B溶液,恰好
![]() 沉淀完全,过滤
加适量C溶液恰
沉淀完全,过滤
加适量C溶液恰 ![]()
好沉淀完全,过滤
(1)写出B、C溶液中溶质的化学式:B ,C
(2)若A是纯净物,无色中性液体也是纯净物,则中性液体是 (填化学式)
(3)若A是纯净物,无色中性液体是只含有一种溶质的溶液,则中性液体是 (填化学式)
(4)写出有色液体与C反应的化学方程式
33.(4分)在一定体积的10%的NaOH溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下表所示:
| 加入盐酸 体积V/ml | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液 温度t/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
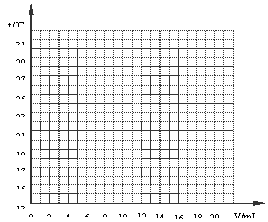
(1) 试绘出溶液的温度与加入盐酸的体积之间
的变化关系曲线。
(2)根据曲线讨论溶液温度变化的原因。
① 加入盐酸的量在2~10mL之间时:
;
② 加入盐酸的量在10~20mL之间时:
。
第一次模拟考试参考答案(化学)
一、二选择题 : 共25分
1-15每题1分。16-20每题2分,有一个或两个符合要求的答案,错选,多选不给分。有两个答案的,只选一个且正确的,给1分。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | B | C | D | C | B | C | A | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | D | D | C | B | C | B | AB | CD | B |
三.(22分)
21.(每空0.5分,共4分)(1)H2(2)CH3COOH;(3)Na2CO3.10H2O(4)H2O
(5)H2、CO、或CH4。(6)NH4NO3;(7)CuSO4
22.(每空1分,共2分)①甘油由C、H、O三种元素组成;②每个甘油分子中有3个C原子,8个H原子,3个O原子;(或③甘油分子中C、H、O原子个数比为3:8:3;④甘油中C、H、O元素质量比为36:8:48。)
23. (每空1分,共2分)②;①④
24. (每空0.5分,共2分)(1)b或c,a或d(2)燃烧需要与氧气接触(3)分子间有间隙(或受压时气体分子间隔缩小等)
25. (方程式每个1分,其余每空0.5分,共8分)
(1)CaO+H2O=Ca(OH)2 化合
(2)3CO+Fe2O3
![]() 3CO2+2Fe
3CO2+2Fe
(3)4Al+3MnO2![]() 2 Al2O3+3Mn 置换
2 Al2O3+3Mn 置换![]()
(4)2AgNO3 2Ag +2 NO2↑ +O2↑ 分解; 不同; +5 +4;
(5)①石蕊;②葡萄糖、氧气
26.(共4分)
(1)可溶于水(0.5分) (2)CaSO4 ;(0.5) Ca(OH)2 (0.5)
(3)不能(0.5);没有气体或沉淀或水生成,不符合复分解反应发生的条件。(1分)
(4)H2SO4+BaCl2=BaSO4↓+ 2HCl (其他合理答案给分)(1分)
四.(22分)
27.(每空1分,共2分)
(1)仪器内壁附着的水既不聚成水滴也不成股流下;(2)立即用湿抹布扑盖。
28.(共9分)(1)③⑤(1分)(2)铁架台,集气瓶;溶解固体。(每空0.5分,共1.5分)
(3)①或③;abf或bh(其他合理答案均给分);向下排空气法。O2或CO2或H2(最后一空0.5分,其余每空1分,共3.5分)
![]() (4)(共3分)
(4)(共3分)
问题一: 2H2O2 2 H2O + O2↑(1分)或用Fe2O3做催化剂
问题二:催化作用;(0.5分) 5%;(0.5分)
问题三:在相同条件下,MnO2的催化效果比 Fe2O3好;(或在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快)。(1分)
29.(共5分)(1)烧杯内的液体倒吸入试管内,气球胀大;(每空1分,共2分)
(2)(3分)
| 实验步骤 | 实验现象 | 解释与结论 |
| 取反应后的溶液,滴入过量稀盐酸,观察 | 有气泡产生 | NaOH 与CO2反应生成了碳酸盐,遇盐酸后有CO2放出 |
30.(共6分)
【交流反思】(每小题1分,共3分)
(1) 没有影响。因为中和反应发生时是酸与碱溶液中的溶质在发生反应,水并没有参与反应。
(2) 实验前向醋酸中滴数滴酚酞试剂,当加入碱液体且过量一滴的时候,就可以看到溶液变成红色,说明醋酸和氢氧化钠已完全中和。
(3) D
【数据处理】(共3分)5%(分步给分。有正确的关系式,运算正确。)
五.(11分)
31.(共2分)(1)14:5:48:12(2)17.72%(3)8.86克(4)虚假(每空0.5分)
32.(每空1分,共5分)
(1)BaCl2 NaOH (2)H2O (3)Na2SO4 (4)CuCl2 + 2NaOH=2NaCl + Cu(OH)2↓
33.(共4分)
(1)(2分)起点、最高点和终点等点表示正确得1分,曲线光滑得1分。
(2)(2分)①随盐酸量增加,中和反应放出热量增加,溶液温度上升。
②过量盐酸起冷却降温作用,反应停止,热量散失。
 浓度
浓度