单元测评
(时间:90分钟,满分:100分)
一、选择题(每题3分,共54分)
1.(2006四川成都中考,4) 某学生在化学晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该学生先后所用的无色液体可能是( )
A.石蕊溶液、稀硫酸 B.酚酞溶液、“雪碧”饮料
C.NaOH溶液、酚酞溶液 D.CuSO4溶液、NaOH溶液
解析:从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,CuSO4溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,答案选C项。
答案:C
2.下图为喷墨打印机工作原理示意图,溶解在打印墨水(pH:7.5—9.0)中的染料,从喷嘴喷到打印纸(pH:4.5—6.5)上,变为不溶于水的固体。下列说法正确的是( )
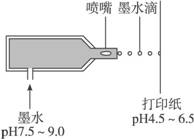
A.打印墨水偏酸性 B.打印墨水呈中性
C.打印纸偏酸性 D.打印纸偏碱性
解析:根据pH的数值判断其显碱性、中性或酸性。打印墨水的pH为7.5—9.0,说明显碱性,则选项A、B错误;打印纸的pH为4.5—6.5,说明显酸性,则选项C正确,选D错误。
答案:C
3.在植物生长过程中,施用氮肥能使枝叶繁茂;施用磷肥能使果实饱满;施用钾肥能使茎杆健壮。种植绿叶蔬菜(如小白菜),相对来说,可施用较多的化肥是( )
A.CO(NH2)2 B.K2SO4 C.KH2PO4 D.Ca3(PO4)2
解析:种植绿叶蔬菜,主要是让其生长茂盛,应施氮肥。尿素〔CO(NH2)2〕属于氮肥。
答案:A
4.下列说法正确的是( )
A.紫色的石蕊试液可以使盐酸变红
B.中和反应一定生成盐和水
C.生成盐和水的反应一定是中和反应
D.测定pH时应先将pH试纸用蒸馏水润湿一下
解析:盐酸可以使紫色石蕊试液变红,A项错误;中和反应一定生成盐和水,B项正确;有些生成盐和水的反应不是中和反应,C项错误;测定pH时如果用水润湿则使溶液稀释,D项错误。
答案:B
5.“绿色化学工艺”是预防污染的基本手段,其理想状态是反应物中的原子全部转化到欲制取的产物中,即原子的利用率为100%。只利用下列反应类型中某一种进行化工生产,一定属于“绿色化学工艺”的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
解析:符合上述要求的只有化合反应,因为它只生成一种物质,原子的利用率肯定为100%,而其他反应类型都有多种产物生成。
答案:A
6.一些国家正在试用用碳酸水浇灌某些植物,其作用是( )
A.促进植物的光合作用 B.调节土壤的pH,改良酸性土壤
C.在植物上方形成温室 D.调节土壤的pH,改良碱性土壤
解析:二氧化碳气体溶于水生成碳酸水,碳酸水显酸性,能改良碱性土壤。同时,碳酸易分解释放出二氧化碳气体,补充大棚内的二氧化碳,能促进植物的光合作用。
答案:AD
7.(2006山东滨州中考,11) 下列各组都是生活中常见的物质,由物质分类知识可知,属于同—类物质的一组是( )
A.红磷、医用酒精、甲烷 B.加碘盐、纯碱、石灰水
C.食醋、氧气、酱油 D.海水、糖水、雨水
解析:D项中的所有物质均属于溶液。
答案:D
8.某同学测定了一些食物的pH如下,根据表格中数据,判断下列有关说法不正确的是( )
| 食物 | 番茄 | 橘子 | 鸡蛋清 | 牛奶 | 玉米 |
| pH | 4 | 3 | 8 | 6 | 8 |
A.胃酸过多的病人适宜多吃橘子 B.胃酸过多的病人适宜多吃鸡蛋清和玉米
C.番茄和鸡蛋清一起食用会降低番茄的酸性 D.橘子汁能使紫色石蕊溶液变红
解析:将酸碱性与pH联系在一起,pH<7,溶液呈酸性;pH>7溶液呈碱性,根据中和反应的原理,胃酸过多再吃橘子会加重胃酸量,不合适,从而选A项。
答案:A
9.从用石灰浆抹的墙壁上掉下的一块白色固体,为探究其成分,进行如下实验:
| 实验操作 | 实验现象 |
| (1)将固体研磨成粉末状,放入烧杯中,加水搅拌 | 固体没有全部溶解 |
| (2)用一支洁净试管取上层清液,滴加酚酞试液 | 溶液呈红色 |
| (3)取不溶物于试管中,滴加稀盐酸 | 有气泡产生 |
由此得出的结论正确的是( )
A.一定含有CaCO3和Ca(OH)2 B.一定含有CaCO3,可能含有Ca(OH)2
C.一定没有CaCO3和Ca(OH)2 D.一定含有Ca(OH)2,可能含有CaCO3
解析:溶液能使酚酞试液变红色,说明显碱性,成分中必然有氢氧化钙;滴加稀盐酸有气泡产生,说明成分中含碳酸根离子,则含有CaCO3。
答案:A
10.小玲对溶液酸碱性及pH的认识正确的是( )
A.溶液的pH越小,碱性越强
B.溶液的pH越大,碱性越强
C.pH=0的溶液显中性,滴入石蕊试液,溶液显紫色
D.在pH=3的溶液中滴加蒸馏水,溶液的pH逐渐变小
解析:从pH与溶液酸碱性的关系图中,我们可以知道,pH越小,溶液的酸性越强;pH=0的溶液呈酸性;pH越大,溶液的碱性越强。不论是酸性溶液还是碱性溶液,加蒸馏水后,其溶液的pH都越来越接近7(中性)。
答案:B
11.将质量分数相同的氢氧化钠与盐酸等质量混合,其混合后溶液的pH( )
A.等于7 B.等于0 C.大于7 D.小于7
解析:根据计算结果判定“酸碱发生中和反应后酸和碱哪种物质过量”是本题的关键,酸和碱反应时的质量比要根据化学方程式计算才能得出,不要相当然的以为酸和碱的质量相等就能恰好完全反应。质量关系如下:
HCl + NaOH====NaCl + H2O
36.5 40
m g m g
从而计算出盐酸过量,溶液呈酸性,pH小于7,故选择D项。
答案:D
12.(2006湖南长沙中考,9) 李洁同学为确定实验室某一失去标签的液体物质,设计如下探究实验方案,其中你认为错误的是( )
A.将液体倒入试管中观察其颜色 B.测量液体的密度
C.滴加紫色石蕊试液检测液体的酸碱性 D.用嘴尝尝液体是甜味还是酸味
解析:实验室里的药品是不能品尝的。
答案:D
13.(2006江西九江模拟,11) 下列关于浓硫酸的性质叙述不正确的是( )
A.浓硫酸有吸水性,所以常用作干燥剂
B.浓硫酸能够使蔗糖炭化,说明浓硫酸具有吸水性
C.用玻璃棒蘸着浓硫酸在白纸上写字,白纸逐渐变黄,最后变黑
D.清华学子用浓硫酸“伤熊”事件,利用了浓硫酸的脱水性
解析:浓硫酸能够使蔗糖碳化,说明浓硫酸具有脱水性而不是吸水性。
答案:B
14.(2006江西九江模拟,8) 下列关于溶液的酸碱性不正确的是( )
A.溶液的酸性越强,H+浓度越大,pH越大
B.溶液的碱性越强,pH越大
C.溶液的酸性越强,H+浓度越大,pH越小
D.酸和碱溶液混合,混合后得到的溶液的酸与原酸溶液相比减弱,与原碱液相比也减弱
解析:溶液的酸性越强,H+浓度越大,pH应该越小。
答案:A
15.(2006江西九江模拟,5) 将两酸、碱溶液混合,得到中性溶液,说明原酸、碱溶液中H+数与OH-数( )
A.相等 B.H+数大于OH-数
C.H+数小于OH-数 D.无法确定
解析:H+数等于OH-数,才能恰好完全中和。
答案:A
16.(2006福建福州中考,14) 不能用于区别稀硫酸和氢氧化钠溶液的是( )
A.紫色石蕊试液 B.NaCl溶液
C.BaCl2溶液 D.CuSO4溶液
解析:稀硫酸呈现酸性,氢氧化钠溶液呈现碱性,可用酸碱指示剂区别;NaCl溶液即不和稀硫酸反应也不和氢氧化钠溶液反应,无法区别;BaCl2溶液可与稀硫酸反应生成白色的硫酸;CuSO4溶液可与氢氧化钠溶液反应生成蓝色的氢氧化铜沉淀。
答案:B
17.(2006安徽非课改实验区中考,8) 现有下列5种物质:①浓盐酸 ②生石灰 ③胆矾 ④烧碱 ⑤铁,把它们长期露置在空气中,其中会发生化学变化且质量增加的是( )
A.①②③ B.②④⑤ C.②③④ D.③④⑤
解析:浓盐酸易挥发,是物理性质,且质量减少;胆矾在空气中失去结晶水,质量减少;生石灰会和空气中的水反应生成氢氧化钙,最后变成碳酸钙,质量增加;烧碱会和空气中的二氧化碳反应生成碳酸钠;铁会被腐蚀生成氧化铁,故选B项。
答案:B
18.(2006湖南长沙中考,7) 我市捞刀河某化工厂发生硫酸泄漏事件。为了减少硫酸对环境的污染,有关部门采取了紧急措施,在泄漏的硫酸上面喷洒了一种化学试剂,你认为这种试剂是( )
A.熟石灰 B.硫酸铜 C.食盐 D.干冰
解析:应喷洒碱性物质,利用酸碱中和减少污染。
答案:A
二、填空题(共40分)
19.(3分)酚酞溶液是实验常用的指示剂,通常把酚酞固体溶解在90%的酒精溶液中配制而成。
(1)取1 g酚酞固体配制成1 000 g酚酞溶液,所得溶液中溶质酚酞的质量分数(质量百分比浓度)为____________。
(2)将2—3滴该酚酞溶液滴入2 mL NaOH的稀溶液中,溶液呈____________色。
(3)在上述有色溶液中,滴加足量____________(填试剂名称),又可以得到无色溶液。
解析:酚酞遇碱溶液变红色,酸中和碱后,溶液呈中性或酸性,酚酞呈无色。
答案:(1)0.1% (2)红
(3)盐酸(硫酸……合理均给分)
20.(8分)向盛有氢氧化钠溶液的烧杯中滴入几滴酚酞试液,试液变为____________色,此时溶液的pH____________,向此溶液中逐滴加入稀盐酸,并不断振荡,直至溶液刚好无色时,溶液呈____________性,pH____________;继续滴入稀盐酸,溶液呈____________色,pH____________,在整个实验过程中,溶液发生了____________反应,化学方程式为____________________________________。
解析:根据酸碱的基本性质和中和反应分析。
答案:红 大于7 中 等于7 无 小于7 中和 HCl+NaOH====NaCl+H2O
21.(5分)你知道镁、锌、铜三种金属的活动性强弱顺序吗?请提出假设:________________________,并设计实验验证你的假设是否正确。
(1)实验所需的药品:________________________________________________________。
(2)实验仪器:______________________________________________________________。
(3)实验报告:
| 实验步骤 | 实验现象 | 结论和化学方程式 |
解析:根据识记的金属活动性顺序表提出假设,并利用金属与酸的反应、金属与可溶性盐的反应设计实验。
答案:假设略。(1)锌片、氯化镁溶液、硫酸铜溶液等
(2)试管、镊子等
(3)
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 在盛有氯化镁溶液和硫酸铜溶液的试管内分别投放几块小粒锌 | 若投入氯化镁溶液中的锌观察不到明显现象,投入硫酸铜溶液中的锌观察到有红色物质析出 | Mg>Zn>Cu Zn+CuSO4====ZnSO4+Cu |
(其他合理答案均可)
22.(4分)据《中国环境报》报道,某化工厂排放的污水,使北海市一条长约50公里的河水受到严重污染,对北海市的工农业生产及人们的生活造成严重危害。经环保部门测定,被污染河水的pH在1—4之间,远远超过国家环保部门对地表水pH的规定。
根据以上提供的材料完成下列问题:
(1)这条河的河水呈( )
A.酸性 B.中性 C.碱性 D.无法确定
(2)如果让你测定该河水的酸碱度,你会选用( )
A.紫色石蕊试剂 B.无色酚酞试剂
C.pH试纸 D.碳酸钠溶液
(3)你认为应如何根治该河水的污染问题?( )
A.往河水里投入大量生石灰
B.在该化工厂附近建一个造纸厂,排放一些碱性废液
C.修建一条暗道,将污水引到市外排放
D.找出污染原因,将废水处理达标后再排放
解析:解答此类选择题,首先要结合每个选择小题仔细阅读材料,提取有关信息。该题必须对溶液酸碱度与pH之间的关系及溶液酸碱性的判断方法要全面掌握。试题提供pH在1—4之间的信息,说明河水显酸性。测定酸碱度应用pH试纸,提供的其他方法都只能判断溶液的酸碱性。河水污染治理不是简单的化学反应和污水转移,应考虑根治方法的合理性。
答案:(1)A (2)C (3)D
23.(2006山东邹城5月模拟,21) (4分)(1)请在下表中各填入一种相应类别物质的化学式:
| 类别 | 单质 | 氧化物 | 酸 | 碱 | 盐 |
| 化学式 |
(2)用上表的五种具体物质,按下列要求写出它们之间相互反应的化学方程式:
①置换反应_______________________________________________________________;
②复分解反应_____________________________________________________________。
解析:单质只含一种元素,如Mg、O2等;氧化物含两种元素且其中一种为氧元素,如H2O、Fe2O3等;酸是由氢离子和酸根离子组成的化合物,如H2SO4、HCl等;碱是由金属离子和氢氧根离子组成的化合物,如Ca(OH)2等;盐是由金属离子和酸根离子组成的化合物,如NaCl、Na2SO4等。另外,填写具体物质时要注意是否便于书写题目中所要求的化学方程式。
答案:(1)Mg CO2 H2SO4 NaOH Na2CO3
(2)①Mg+H2SO4====MgSO4+H2↑ ②2NaOH+H2SO4====Na2SO4+2H2O
24.(4分)一些食物的近似pH如下表。请完成下列问题:
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米粥 |
| pH | 2.9—3.3 | 3.5—4.5 | 6.3—6.6 | 7.6—8.0 |
(1)苹果汁和葡萄汁相比较,酸性较强的是____________,它使紫色石蕊试液变__________色。
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的____________。在医疗上,治疗胃酸过多的药物之一是碳酸氢钠,其俗名为____________,请写出它与胃酸中盐酸反应的化学方程式_________________________________________________________。
解析:pH<7的溶液显酸性且数值越小酸性越强,显酸性的物质能使紫色石蕊试液变红色;pH>7的溶液显碱性,显碱性的物质能中和酸性物质。
答案:(1)苹果汁 红
(2)玉米粥 小苏打 NaHCO3+HCl====NaCl+H2O+CO2↑
25.(2分)有三种物质:①二氧化碳,②生石灰,③食盐。把它们分别放入或通入蒸馏水中,所得溶液的pH由小到大的排列顺序为(用序号填写)________________________。
解析:解题时应知道二氧化碳溶于水生成的碳酸呈酸性,pH<7;生石灰与水接触会发生反应生成氢氧化钙,氢氧化钙溶液就是石灰水,石灰水呈碱性,pH>7;食盐水呈中性,pH=7。
答案:①③②
26.(4分)为弄清“显酸性的溶液一定是酸吗”这一疑问,张生同学进行了下列探究活动。
向微型实验仪器(如下图)井穴板的4个井穴中分别滴加稀盐酸、醋酸、硫酸铝、氯化铵四种溶液各3滴,再分别滴一滴紫色石蕊试液。观察到四种溶液均变红色。
![]()
井穴板每一井穴为一个反应容器
(1)本实验说明这四种溶液都显____________性,溶液的pH____________7(填“>”“=”或“<”)。
(2)分析实验过程和现象,你还能得出哪些结论?
①________________________________________________________________________;
②________________________________________________________________________。
解析:能使紫色石蕊试液变红的溶液显酸性,其pH<7,但不一定都是酸。
答案:(1)酸 <
(2)①显酸性的溶液不一定是酸 ②有些盐溶液也显酸性(其他合理答案也可)
27.(6分)一般情况下,金属越活泼,与酸反应的速度越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验。
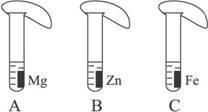
【实验步骤】
①取A、B、C三支试管,分别加入2 mL溶质质量分数相等的稀盐酸;
②分别加入足量的、大小相等的Mg、Zn、Fe三种金属片,立即把三个相同的气球分别套在各试管口上。
【实验预测与分析】
(1)写出铁与稀盐酸反应的化学方程式:________________________________________。
(2)气球膨胀速度最快的是____________(填试管编号)。
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是:_______________。
(4)步骤②是实验成功的关键,你认为在操作过程中小组成员之间应该:_________________。
解析:答题时要结合金属活动性顺序来思考问题。
答案:(1)Fe+2HCl====FeCl2+H2↑ (2)A
(3)锌与酸反应的速率适中,容易控制(或镁与酸反应速率太快,而铁与酸反应速率太慢)
(4)分工合作,团结协作等(其他合理答案均可)
三、计算题(共6分)
28.(6分)人体内胃酸的主要成分是盐酸,胃酸过多,可引起一系列胃病。最近,美国食品与药品管理局批准胃酸完全抑制剂(Pepcid Commplete)上市,作为治疗胃酸分泌过多的药品,这药品的标签如下图。试通过计算说明,患者按处方服用该药一天,理论上可消耗HCl多少毫克?
| 药品名称 胃酸完全抑制剂(Pepeid Complete) 主要成分 每片内含碳酸钙800 mg和氢氧化镁116 mg 作用用途 用于胃酸过多、烧心型消化不良等 用法、用量 口服 一次1片 每日2次 |
解析:根据反应:
CaCO3 + 2HCl====CaCl2+CO2↑+H2O
100 73
2×800 mg x
x=584 mg
Mg(OH)2+2HCl====MgCl2+2H2O
58 73
2×116 mg y
y=292 mg
所以,每天消耗的盐酸的质量为292 mg+584 mg=876 mg
答案:876 mg
| 自我盘点 | |
| 我认为本章的主要内容可分为这几个方面: | |
| 在学习本章内容时,我所采用的学习方法是: | |
| 在学习本章内容时,我的心情是这样的: | |
| 在学习本章的过程中,我最大的感受是: | |
| 在学习本章后,我记住并能应用的知识是: | |
| 我将这样来弥补自己在本章学习中所存在的不足: | |