中考化学试题2
(考试时间:90分钟 满分100分)
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 S:32 Si:28 Cl:35.5 Na:23 Mg:24 Al:27 Cu:64
一、选择题(本题共17小题,每小题2分,共34分,每小题只有一个选项符合题意,将它的编号填入下表对应的空格中。)
1、我国“嫦娥工程”探月计划的一个重要目标是开发月球新能源——“氦—3”,10吨氦—3就能满足我国一年所有的能源需求。关于氦原子的说法正确的是
A、质子数为3,电子数为3 B、质子数为2,电子数为2
C、质子数为2,电子数为3 D、质子数为3,电子数为2
2、据《新科学家》杂志网站3月29日报道,欧洲航天局科学家近日利用“火星快车”探测器探测到火星上有甲烷存在,它可能是火星上存在生命的有力证据。甲烷属于
A、氧化物 B、单质 C、无机物 D、有机物
3、在互联网上用google搜索 “中央电视台每周质量报告”时,可搜索到被曝光的事件中一定涉及到化学变化的是
A、用淀粉、蔗糖、奶香精等掺和成“假奶粉”
B、用工业石蜡等给瓜子“美容”
C、用硫磺燃烧法熏蒸粉丝
D、用毛发水、酱色、水、盐等兑制成“假酱油”
4、“绿色奥运”是2008年北京奥运会的主题之一。为减轻大气污染,在汽车尾气排放口加装“三效催化净化器”,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体,该气体是
A、N2和CO2 B、CO2和NO2 C、CO2和O2 D、CO2和NH3
5、臭氧层是地球的保护伞,NO气体破坏臭氧层时会发生O3+NO=NO2+O2的反应,该反应中的氧化剂是
A.O3 B、NO C、NO2 D、O2
6、4月18日火车开通后,为进一步优化我市旅游环境,某同学提出如下建议:①使用无磷洗衣粉②使用无铅汽油③禁止焚烧农作物秸杆④禁止燃放烟花爆竹⑤分类回收垃圾⑥提倡使用一次性发泡塑料餐具和塑料袋。上述建议中不可采纳的有
A、③ B、② C、⑥ D、⑤
7、生活中化学无处不在,下列说法错误的是
A、白酒应密封保存是因为乙醇有挥发性
B、醋酸鉴别食盐与纯碱是利用醋酸的酸性
C、游泳池中加硫酸铜消毒杀菌是利用其毒性
D、活性炭除冰箱中异味是利用碳的稳定性
8、“雪碧”等碳酸型饮料的pH小于7,晃动后打开瓶盖,其pH将
A、变大 B、变小 C、不变 D、无法判断
9、对下列实验现象描述正确的是
A、氯化铜溶液中加入铁粉后,溶液颜色变为无色
B、硫酸铵中加入氢氧化钠溶液后,微热有无色无味的气体生成
C、硫酸铜溶液中滴加氢氧化钾溶液时,有蓝色沉淀产生
D、酚酞试液中通入二氧化碳变红
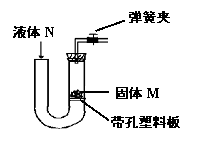 10、右图所示装置可用于实验室制取某些气体,并能随开随用,随关随停。下表中所选用的药品及制取的气体完全正确的一组是
10、右图所示装置可用于实验室制取某些气体,并能随开随用,随关随停。下表中所选用的药品及制取的气体完全正确的一组是
| 选项 | 选用的药品 | 制取的气体 | |
| 固体M | 液体N | ||
| A | 大理石 | 稀硫酸 | 二氧化碳 |
| B | 锌粒 | 浓硫酸 | 氢气 |
| C | 大理石 | 稀盐酸 | 二氧化碳 |
| D | 碳酸钠 | 稀硫酸 | 二氧化碳 |
11、下列说法正确的是
A、有单质参加的反应一定是化合反应
B、稀溶液一定是不饱和溶液
C、任何物质的溶解度随温度升高均增大
D、非金属氧化物不一定都能与碱发生反应
12、为预防禽流感,某同学为养鸡场配制消毒液,在用量筒量取浓的氯胺(NH2Cl)消毒液的体积时仰视读数,量取水的体积时俯视读数(其他操作过程均正确),则所配消毒液的浓度
A、无影响 B、偏大 C、偏小 D、无法确定
13、下列各组物质中,仅用一种试剂不能鉴别的一组是
A. Cu粉 Fe粉 Fe2O3粉 B. Na2CO3 BaCl2 KNO3
C. NaCl固体 CuSO4固体 CaCO3固体 D.(NH4)2SO4 KNO3 NaNO3
14.下列实验操作中,正确的是
A. 试管内壁有油脂时,可用热的纯碱溶液洗涤
B.进行粗盐的提纯实验时,将滤液蒸干后停止加热
C.向试管中滴加液体时,滴管应紧贴试管内壁
D.称量氢氧化钠固体时直接将其放在托盘天平左盘的滤纸上
15、某同学想用实验证明硫酸铜溶液显蓝色与SO42-无关,只进行下列实验无意义的是
A、 观察硫酸钠溶液没有颜色
B、 向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C、 向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D、加水稀释硫酸铜溶液,溶液蓝色变浅
16、青少年应“珍爱生命,远离毒品”。海洛因是一种常见毒品,其元素质量分数分别为:C:68.29%,H:6.23%,O:21.68%,其余为氮。若已知其相对分子质量不超过400,则一个海洛因分子中氮原子个数为
A、3 B、1 C、2 D、4
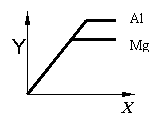 17、如图表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是
17、如图表示等质量的金属Mg和Al分别与足量且质量分数相等的稀硫酸反应,下列叙述正确的是
A、X表示反应所用时间,Y表示生成氢气的质量
B、X表示生成氢气的质量,Y表示反应所用时间
C、X表示滴加稀硫酸的质量,Y表示生成氢气的质量
D、X表示参加反应的金属的质量,Y表示生成氢气的质量
二、选择题(每小题有1~2个选项符合题意,请将它的编号填入下表对应的空格中。若只有一个选项符合题意,错选、多选均不给分;若有两个选项符合题意,只选一个且正确的给1分,选两个且都正确给2分,但只要选错一个就不给分。本题共5小题, 10分。)
18、双球洗气管常用于气体除杂、干燥、吸收(可防倒吸)等实验。为吸收某气体并检验其性质进行图中实验,发现紫色石蕊试液变色。请根据表中的数据判断左方进入的气体可能是


A、NH3 B、HCl C、CO2 D、O2
19、下列说法正确的是
A 、NaOH和MgO的混合物中氧的质量分数为40%,NaOH和MgO的质量一定相等
B、一定量的氯化钠溶液恒温蒸发5克水,析出a克晶体;再蒸发5克水,又析出b克晶体,a与b一定相等
C、用H2完全还原一定质量的CuO,参加反应的H2与通入的H2质量一定相等
D、将98%的浓H2SO4稀释成49%的稀H2SO4,加入水的质量与浓硫酸质量一定相等
20、下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 盐酸 | 蒸发 |
| B | CO2(CO) | O2 | 点燃 |
| C | Fe (Zn) | 稀硫酸 | 过滤 |
| D | CO2(HCl) | NaOH溶液 | 洗气 |
21、醋酸、甲醛的化学式依次是C2H4O2、CH2O,关于它们的说法正确的是
A、任意比混合二种化合物并溶解于水,所得混合液中H、O元素质量比无法确定
B、任意比混合二种化合物并溶解于水,所得混合液中H、O元素质量比是定值
C、任意比混合二种化合物,完全燃烧产生的二氧化碳与水的质量比是22:9
D、任意比混合二种化合物,完全燃烧产生的二氧化碳与水的质量比无法确定
22、只含铜、氧两种元素的固体样品9.0克,测得其中含铜元素的质量为8.0克。已知铜的氧化物有CuO和Cu2O,下列说法正确的是
A、固体样品的组成只有2种情况 B、固体样品一定是CuO与Cu2O的混合物
C、固体样品可能是Cu2O D、若固体样品由两种物质组成,则其中一种质量分数为4/9
三、填空题(本题共6小题, 22分)

23、俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形。下表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
| H 1 | He 2 | ||||||||||||||||
| Li 3 | Be 4 | B 5 | C 6 | N 7 | O 8 | F 9 | Ne 10 | ||||||||||
| Na 11 | Mg 12 | Al 13 | Si 14 | P 15 | S 16 | Cl 17 | Ar 18 | ||||||||||
| ① | ② | ③ | |||||||||||||||
(1)用符号表示:带两个单位负电荷且质子数为8的离子 (写一种)。
AB2型化合物 、 (写两种)。
(2)去年底重庆开县发生天然气“井喷”事件。喷出的气体中有一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,请用符号和数字表示:3个A2B分子 。
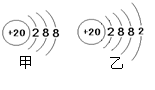 (3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是
,请预测质子数为20的元素在表中的位置 (填①、②、③)。该元素离子的结构示意图是 。(填“甲”或“乙”)
(3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是
,请预测质子数为20的元素在表中的位置 (填①、②、③)。该元素离子的结构示意图是 。(填“甲”或“乙”)
24、用H、O、C、Fe、Ca四种元素组成符合下列要求的物质的化学式:
(1)可作火箭高能燃料的单质是 ;
(2)制造刀具的高碳钢的主要成分 ;
(3)可用于人工降雨的一种氧化物 ;
(4)配制波尔多液的一种碱 。
25、(1)打火机中的燃料主要成分可表示为C4H10,请写出C4H10完全燃烧的化学方程式:
。
(2)手机、笔记本电脑等电子产品中使用的锂电池具有体积小、放电时间长等优点,其放电时的工作原理是锂(Li)与二氧化锰作用生成LiMnO2,请写出该反应的化学方程式 。
(3)6月5日是世界环境日,今年的主题是“海洋存亡,匹夫有责”。海洋中资源丰富,如碘(I2)的获得可将海藻、海带经处理后所得的NaI溶液与Cl2发生置换反应而得到的,其化学方程式为 。
26、为探究铜丝在酒精灯火焰上灼烧后表面黑色固体的成分,设计如下过程:
(1)提出假设:黑色固体可能是C、 中的一种或两种。
(2)验证假设:灼烧后的铜丝插入足量稀硫酸中,若溶液变蓝,说明必有 ;若溶液中有黑色不溶物,说明必有 。
27、一种与金刚石硬度相近的新型无机非金属材料M,它由两种A、B非金属元素组成,其中A在地壳中含量占第二位,B在空气中含量最多。A元素符号是 ;该无机非金属材料中A、B元素的质量比为3:2,则M的化学式为 。
28、混盐一般是由一种阳离子与两种酸根离子组成的盐,如:Ca(NO3)Cl。漂白粉中有一种混盐CaOCl2(其中钙元素化合价为+2,氧元素化合价为-2)。(1)请将该混盐改写成如Ca(NO3)Cl的形式,其化学式表示为 。(2)该混盐中氯元素的化合价为 。
四、推断题(本题共2小题, 12分)
29. 理性推测是化学研究的一种重要手段。A、B、C是中学化学中常见的化合物,其中C是正盐,已知:A+nB =C +H2O (方程式已配平),n为化学计量数。请回答下列问题:
(1)当n=1时,B是一种常见的酸,其相对分子质量是98,C的相对分子质量为120。则B的化学式为 ,A的相对分子质量为 ,经推测A的化学式为 。
(2)当n=2时,请各列举出一个化学反应方程式:
若A是一种酸性氧化物 ;若A是一种碱性氧化物 。
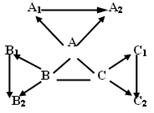 30、“三酸两碱”是几种重要的化工原料。下图是九种化合物相互间的反应关系。已知①A、A1、A2是工业上三大常见的强酸,B、B1、B2是正盐,C、C1、C2是碱。②B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子。
30、“三酸两碱”是几种重要的化工原料。下图是九种化合物相互间的反应关系。已知①A、A1、A2是工业上三大常见的强酸,B、B1、B2是正盐,C、C1、C2是碱。②B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属阳离子。
③A+B→CO2↑,
B+C→难溶于水的白色沉淀
![]() 沉淀完全溶解,并产生二氧化碳,
沉淀完全溶解,并产生二氧化碳,
A+C→难溶于水的白色沉淀![]() 沉淀不溶解
沉淀不溶解
请回答:(1)有关物质的化学式:B2 ,C1 。
(2)有关反应的化学方程式:
A+B: ;
B+C: ;
A+C: 。
(3)C2可能的化学式(写两个): 、 。
五、实验题(本题共2小题, 16分)
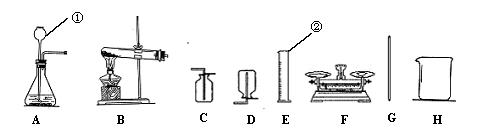 |
31.根据下图仪器和装置填空:
(1)写出图中①②仪器的名称: ① ② 。
(2)为完成下列实验,请选择所需的仪器或装置,并将其编号填在横线上。
Ⅰ、实验室制取并收集氧气 。
Ⅱ、实验室制取并收集氢气 。
Ⅲ、配制50g 5%的氯化钠溶液需要用到的玻璃仪器 。
32.我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:
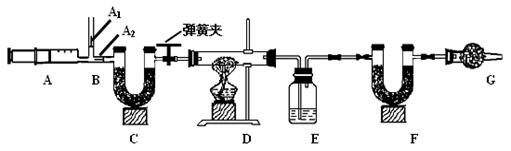
已知:1、碳酸钠比较稳定,加热时不分解 ;2、2NaHCO3![]() Na2CO3↑ +CO2 ↑ +H2O
Na2CO3↑ +CO2 ↑ +H2O
3、图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
(一)实验步骤 ①组装好装置,检查气密性②反复推拉注射器③称量E、F的质量④关闭弹簧夹,加热D处试管直到反应不再进行⑤打开弹簧夹,再次反复缓缓推拉注射器⑥再次称量E、F的质量。
(二)问题探究:
(1) E中的药品为 ,E的作用是 。C、F、G中装有碱石灰(CaO与NaOH的固体混合物),则C的作用是 ,F的作用是 ,G的作用是 。
(2)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数 (填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是
 。
。
(3)据右表,16.6g天然碱中结晶水的质量为 g,,
Na2CO3的质量为 g,
该天然碱的化学式中a:b:c= 。
六、计算题(本题共1小题,6分)
33.我市天山汉墓出土青铜器表面一些有绿色物质,该物质俗称“铜绿”,其化学组成为Cu2(OH)2CO3。小明同学研究该物质时做了下列实验。
【实验一】 取2.22 g “铜绿”固体,向其中加入足量的7.3%的稀盐酸,使固体完全溶解。反应方程式为:
Cu2(OH)2CO3+4HCl=2CuCl2+CO2 ↑+3H2O,试求参加反应的稀盐酸的质量。
【实验二】 (1)另取2.22 g“铜绿”固体加热使其分解,绘制出固体的质量随温度的变化关系图。如图到t1℃时全部变为黑色固体,则此过程中生成的二氧化碳和水的总质量为 g。
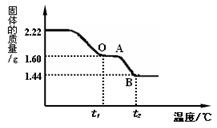
(2)根据上图,计算并推理出升温到t2℃后,BC段残留固体的合理化学式(要求有计算过程)。
初中毕业、升学统一考试
化学参考答案及评分标准
【评卷说明】
1.所有专业术语、化学用语(符号、化学式等)错误均不给分。
2.化学方程式未配平不给分。
3.文字表达只要答到关键词即可得分。
4.答题中其它合理的说法和解法均可得分。
一、选择题(每小题2分,共34分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | C | A | A | C | D | A | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | C | D | B | D | A | D | B | C |
二、选择题(每题有1~2个选项符合题意,请将它的编号填入下表对应的空格中。若只有一个选项符合题意,错选、多选均不给分;若有两个选项符合题意,只选一个且正确的给1分,选两个且都正确给2分,但只要选错一个就不给分。本题包括5小题,共10分。)
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 | AB | D | A | BC | CD |
三、填空题(本题包括6小题,共22分,除28题最后一空2分外,其余每空1分。)
23.(1)O2- ;SO2、CO2(MgCl2、SiO2、NO2、MgF2、BeCl2、BeF2、CS2等均正确)。
(2)3H2S (3)质子数依次增大(其他合理的均给分)、②、甲。
24.(1)H2 (2)Fe (3)CO2 (4)Ca(OH)2
25.(1)Li+MnO2=LiMnO2(2)2C4H10+13O2 ![]() 8CO2+10H2O(3)Cl2+2NaI=I2+2NaCl
8CO2+10H2O(3)Cl2+2NaI=I2+2NaCl
26.(1)CuO (2)CuO 、C。
27.Si,Si3N4(如写成N4Si3也给分)
28.(1)Ca(ClO)Cl(写成CaCl(ClO)、Ca(OCl)Cl、CaCl(OCl)均给分,次氯酸根无括号也给分)
(2)-1和+1(共2分,只写1种给1分,写错或一对一错不得分。)
四、推断题(本题包括2小题,每空1分,共12分)
29.(1)H2SO4、40(写40g不给分)、MgO
(2)CO2+2NaOH=Na2CO3+H2O(或CO2(SiO2、SO3、SO2等)+2NaOH(KOH)等)
CuO+2HCl=CuCl2+H2O(或CaO(BaO、MgO)+2HCl(HNO3)等);
30.(1)NaCl、NaOH
(2) A+B:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;
B+C:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;
A+C:H2SO4+Ba(OH)2=BaSO4↓+2H2O
(3)Cu(OH)2、Mg(OH)2(其他如:Fe(OH)3等不溶碱均可)
五、实验题(本题包括2小题,每空1分,共 16分)
31.(1)①长颈漏斗② 量筒(2)Ⅰ、 B C Ⅱ、A D Ⅲ、EGH (错、漏均为0分)
32.(1)E中药品:浓硫酸(浓H2SO4)。 E的作用:吸收水蒸气。
C的作用:除去空气中的二氧化碳、水蒸气等杂质气体。F的作用:吸收二氧化碳。
G的作用:防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定。
(答到关键词即可)
(2)不能,偏小,使生成的二氧化碳、水蒸气吸收充分。(防止气流速度过快,二氧化碳、水蒸气未被完全吸收)
(3)1.8g, 10.6g, 2:1:2。
六、计算题(本题1小题,共6分)
33.【实验一】(1)解:设参加反应的稀盐酸的质量为x
![]() Cu2(OH)2CO3+4HCl=2CuCl2+CO2
↑ +3H2O
Cu2(OH)2CO3+4HCl=2CuCl2+CO2
↑ +3H2O
222 146
2.22g 7.3%x
222:2.22= 146:7.3%x ……3分 (列式正确得2分,答案正确得1分)
∴x = 20g
【实验二】(1)0.62g ………1分
![]() (2)解:根据图中数据知:
(2)解:根据图中数据知:
![]() 从t1℃到t2℃固体的质量减少:1.60g-1.44g=0.16g
从t1℃到t2℃固体的质量减少:1.60g-1.44g=0.16g
t1℃时1.60g氧化铜中铜元素质量=1.60g× =1.28g
…………求出Cu2O中铜、氧
元素质量得1分
t1℃时1.60g氧化铜中氧元素质量=1.60g×![]() =0.32g
=0.32g
因为:BC段固体中氧元素质量为:0.32g-0.16g=0.16g,
所以,BC段固体中铜、氧元素质量比=1.28g : 0.16g=8:1
设BC段固体的化学式为CuxOy,
则,64x : 16y=8:1, x :y=2 : 1(或Cu、O元素原子个数比=![]() =2 :1)
=2 :1)
所以BC段时固体化学式为Cu2O。……………1分
※ 其他合理解法均给分。如:假设验证法。假设BC段固体为Cu或Cu2O。(1分)则由铜元素质量是0.64g可知,最后1.44g中不仅含铜元素,还含有氧元素,因此是Cu2O(1分)。
【备注】1、该题第(2)问分两个部分给分:求至Cu2O中Cu、O元素质量得1分;求出Cu2O的Cu、O元素原子个数比(或直接设化学式求个数比)即得1分。
2、鼓励创新的答案,但是若只写答案Cu2O,无任何过程不给分。