初中升学考试理科综合试卷化学部分
一、选择题(每小题2分,共16分)
7.化学与人类生存和发展息息相关,下列粒子中,不属于化学学科研究对象的是
A.中子 B.分子 C.原子 D.离子
8.物质的运动是永恒的。请你判断下列物质的运动不属于物理变化的是
A.用自来水制蒸馏水 B.从空气中分离制氧气
C.晾干的咸菜表面出现食盐晶体 D.菜刀保管不慎生成铁锈
9.实验室制取CO2、H2、O2的化学反应中,下列反应类型没有涉及到的是
A.复分解反应 B.化合反应 C.分解反应 D.置换反应
10.供家用煤炉燃烧的煤制成蜂窝状,这是为了
A.增加空气中O2的体积分数 B.使煤燃烧产生的热量不易散失
C.增加煤与O2的接触面积 D.延缓煤的燃烧时间,节约能源
11.黄蜂的刺激液呈酸性。被黄蜂蛰伤的人体部
位涂抹下列哪种物质可明显减轻疼痛
A.纯净水(pH~7) B.苹果汁(pH≈5) C.牛奶(pH~6.5) D.牙膏(pH~9)
12.葡萄糖与O2作用是动植物呼吸的主要反应:C6H12Ox+6O2=6CO2+6H2O,请判断C6H12Ox中,x的值应为
A.12 B.9 C.6 D.3
13.中国铁锅盛行世界,铝制炊具正在淘汰。下面对铁、铝两种金属的叙述中,错误的是
A.铁与盐酸反应生成FeCl3
B.铝与盐酸反应生成AlCl3
C.铁的金属活动性不如铝的金属活动性强
D.常见化合物中,铁有+2、+3价,铝只有+3价
14.下列物质中,一般不能与其它物质发生复分解反应的是
A.HCl B.KNO3 C.CaCO3 D.NaOH
三、(本大题包括4小题,满分12分)
26. 已知叶绿素的化学式(分子式)为(C35H74O5N4Mg),由此可知叶绿素共有 种,每个叶绿素分子中共有 个原子核。
27.“侯氏制碱法”制得的优质纯碱的分子式为 ;工业酒精勾兑的白酒中致人于死地
的物质是 ;常作制冷剂和人工降雨的固态CO2的俗名叫 ,
28.下表是市场上销售的一种常见氮肥的包装说明书。请阅读有关内容后,回答下列问题:
(1)NH4Cl和K2SO4都是可作化学肥料的物质。虽然它们没有共同的组成元素,但在物质(化合物)的分类中它们同属于 类。
| 主要成分 | NH4Cl |
| 保存方法 | 干燥阴凉处存放 |
| 含氮量 | ≥25% |
(2)化学肥料通常所说的“含氮量”中的“氮”是指 (填序号)。
A.氮分子 B.氮原子 C.氮离子 D.氮元素 E.NH4+
(3)请根据上述氮肥的保存方法,推测NH4Cl的性质之一是 。
29.观察KNO3和NaCl的溶解度曲线,回答下列问题:
(1)若分别从KNO3、NaCl的纯溶液中提取KNO3、NaCl晶体,
应采用 结晶法;若从含少量NaCl的KNO3,宜
采用 结晶法。
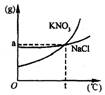 (2)在t℃时,KNO3和NaCl分别形成的饱和溶液中的某
(2)在t℃时,KNO3和NaCl分别形成的饱和溶液中的某
些物理量间存在等量关系,请你写出其中两个(用文字表述):
四、本大题包括三小题,满分12分。
30.(3分)请将下列中正确操作的代号填写在横线上 (错填倒扣分)。
a.实验用剩余的药品放入指定的容器内
b.用燃着的酒精灯点燃另一酒精灯
c.将水慢慢注入盛浓H2SO4的量筒中稀释浓H2SO4
d.给试管里的物质加热时,先进行预热
e.实验室用排水法收集O2结束,先将导管从水中取出,然后移去酒精灯。
3l.(4分)下面是张华同学对未知气体M的研究论文摘要,请仔细阅读后回答问题。
M在通常状态下是一种无色有刺激性气味的气体,密度比空气小,置于空气中不变质,极易溶于水,在实验室由A和B的固体混合物加热制得。该物质在催化剂A的作用和加热的条件下与O2反应,生成氮的一种氧化物和水。
(1)实验室制取M气体的发生装置应与实验室制 的发生装置相同:其收集方法应采用 。
(2)M中肯定含有的元素是 ;不能确定是否含有的元素是 。
32.(5分)推广乙醇汽油是缓解能源危机的措施之一。乙醇汽油不完全燃烧的产物中可能含有CO、CO2和H2O。请结合下列装置,回答对其产物检验中的有关问题。
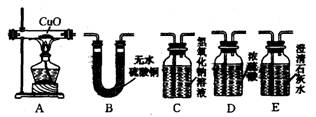 |
(1)检验乙醇汽油的燃烧产物,应首先用 装置(填代号,下同)检验H2O的存在;其次用 装置检验CO2的存在。
(2)检验CO的常用方法是:将待检气体通过A装置后再验证其产物CO2。故该实验中,A装置前应连接C装置的作用;是 ;CO通过A装置时发生反应的化学方程式为 ;本实验中确认CO2存在的化学反应方程式为 。
五、本大题包括1 小题,满分10分。
33.(10分)某矿井采出的食盐(俗称井盐)中含有CaCl2,为设计除杂方案需测定CaCl2的含量;取上述井盐22.8g,向其中加入100g质量分数为10.69%的Na2CO3溶液恰好完全反应。若样品检测过程在露℃的恒温下进行,此时NaCl的溶解度为36g。
(1)取样检测后的溶液中,Na+与Cl-的数量比为 。
(2)求检测后的溶液中NaCl的质量及井盐中CaCl2的质量分数(结果保留一位小数)。
(3)请通过相关计算判断,取样检测后的溶液是否为t℃时的NaCl饱和溶液?
参考答案
7~10 ADBC 11~14 DCAB
26.五(或5),139
27.Na2CO3(或Na2CO3·10H2O),甲醇(或CH3OH),干冰
28.(1)盐 (2)D (3)NH4Cl易潮解,NH4C1易溶于水,NH4Cl高温下不稳定,NH4Cl高温下易分解,NH4Cl高温下易“升华”,NH4Cl见光受热不稳定等其它合理推测或表述,只要有其中之一即可
29.(1)蒸发溶剂(或蒸发),降温
(2)①t℃时,KNO3和NaCl的溶解度相等;②t℃,KNO3和NaCl的饱和溶液中溶质(或溶
剂)的质量分数相等 ③t℃时,KNO3和NaCl的饱和溶液中,溶质的质量与溶剂的质量比(或溶液质量与溶剂质量比,溶液质量与溶质质量比)相等;④t℃分别取等量KNO3饱和溶液和NaCl饱和溶液,其中所含溶质(或溶剂)的质量相等。其他合理的均可。
30. a、d、e
31.(1)O2(或氧气),向下排空气法 (2)N、H(或氮,或氢),O(或氧)
32.(1)B E (2)充分吸收CO2,防止CO2对CO检验产生干扰
33.(1)1:1
(2)所设取样品中CaCl2的质量为x,反应生成NaCl的质量为y
CaCl2+Na2CO3=CaCO3↓+2NaCl
1l1 106 117
x 100g×10.6% y
![]() 11.1g
11.1g
![]() 11.7g
11.7g
则m(NaCl)=(22.8-11.1g)+11.7g=23.4g
ω(CaCl2)=![]() =48.7%
=48.7%
(3)溶液中水的质量:100g×(100%-10.6%)=89.4g
设t℃时89.4g水中NaCl的最大溶解量为m
则100g:36g=89.4g:m
m==![]() =32.2g>23.4g
=32.2g>23.4g
故样品检测后的溶液不是t℃时的NaCl饱和溶液