化学中考题精选
1.在CaCO3→Ca(OH)2→NaOH和各步转化中,没有涉及到的基本反应类型是
A.复分解反应 B.化合反应 C.置换反应 D.分解反应
2.甲、乙两种不含结晶水的固体物质在不同温度下的溶解度如下:
| 0℃ | 20℃ | 30℃ | 50℃ | 80℃ | |
| 甲 | 13.3g | 31.6g | 36.2g | 85.8g | 169g |
| 乙 | 35.7g | 36.0g | 36.2g | 36.5g | 37.1g |
根据上表中的数据进行判断,下列有关说法正确的是
A.甲的溶解度大于乙的溶解度
B.30℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等
C.使乙物质从它的一定温度下的饱和溶液中析出,一般采用冷却的方法
D.升高温度可使用的不饱和溶液转变为饱和溶液
3.下列是小明同学用连线方式对某一主题的知识进行归纳的情况,其中不正确的是
A.关于物质(或粒子)与结构的连线情况:
C60和金刚石——碳原子的排列方式不同
CO和CO2——分子的构成不同
Na原子和Na+——核外电子数不同
B.关于物质分类的连线情况:
纯碱——盐
海水——混合物
干冰——氧化物
C.关于物质的变化与反应条件的连线情况:
光合作用——光照
水的分解——通电
高锰酸钾的分解——加热
D.关于溶液的连线情况:
升高温度——使多数固体溶质更多的溶解
浓溶液——无法溶解更多的溶质
饱和溶液——浓度大的溶液
4.下列说法正确的是
A.浓硫酸不慎滴到手上,立即用大量水清洗,再涂上氢氧化钠溶液
B.使用托盘天平时,只要其位置发生改变,都必须首先调节天平平衡
C.用pH试纸测定某溶液的酸碱性强弱时,先用蒸馏水将试纸湿润,然后再将该溶液滴在湿润的pH试纸上,然后与标准比色卡比较,确定溶液的pH
D.用量筒量取35.96mL的盐酸
5.一定条件下,硫酸溶液中溶质质量分数越大,与镁反应的速率就越快。现用100g质量分数为30%的硫酸溶液与过量的镁粉反应,为使反应减慢而又不影响生成氢气的总量,可向硫酸溶液中加入
A.氢氧化钠 B.10%硫酸溶液 C.水 D.碳酸钠溶液
6.下面各种物质的用途,与其化学性质有关的是
①氢气填充探空气球 ②焦炭冶炼生铁 ③熟石灰改良酸性土壤 ④大理石作装饰材料
⑤煤气作燃料
A.①③⑤ B.②③④ C.②③⑤ D.③④⑤
7.下列除去物质中少量杂质的方法,合理可行的是
A.加热可除去镁粉中少量的氧化镁
B.除掉二氧化碳中混有的少量一氧化碳,可采取点燃的方法
C.蒸发溶剂法能较好地除去硝酸钾中的少量氯化钠
D.用适量消石灰可除去氢氧化钠溶液中的少量碳酸钠
8.下面对某些物质的有关因果关系的说法中,不符合事实的是
A.碳的化学性质在常温下稳定,用墨书写或绘制的字画可长久保存
B.浓硫酸具有难挥发性有吸水性,可用来干燥各种气体
C.粗盐因含有氯化镁、氯化钙等杂质,会吸收空气里的水分而潮解
D.碳酸钠与盐酸的反应速率过快,不宜用于实验室制取二氧化碳
9.生活中处处充满化学,下列叙述中从化学视角看正确的是
A.铁制品在干燥的空气中易生锈
B.用纯碱溶液清除水壶中的水垢
C.用“碳素墨水”书写重要文件,以便于保存
D.硫酸铜可以用于游泳池水消毒,也可用于饮用水消毒
10.向FeSO4和CuSO4的混合溶液中投入一些锌粉,充分反应后滤出不溶物。向滤出的不溶物中加入少量稀硫酸,有气泡产生。对该不溶物成分的下列 判断中正确的是
①一定含有Zn ②一定含有Fe ③一定含有Cu ④可能含有Zn ⑤可能含有Fe
⑥可能含有Cu
A.②③④ B.①②③ C.③④⑤ D.①②④
二、填空与简答题
11.有以下几种物质:①干冰 ②水银 ③洁净的空气 ④冰和水的混合物,属于混合物的是 (填序号,下同),属于单质的是 。
12.20℃时,小华将溶剂质量相同的A、B两杯蔗糖溶液同时放入温度为℃的冰箱中,并不间断地进行观察,发现A杯首先析出晶体,推测它们质量分数的关系A B(填“>”、“<”、“=”)。
13.自行车的主要部件是由钢铁制成的,自行车厂为防锈所采取的方法有(至少写出两种):
; 。
14.天原化工厂以食盐和水为原料生产化工产品,食盐水经电解可获得氯气,反应的化学方程式为2NaCl+2H2O![]() 2X+Cl2↑+H2↑,试推断X的化学式
,该物质俗称
。
2X+Cl2↑+H2↑,试推断X的化学式
,该物质俗称
。
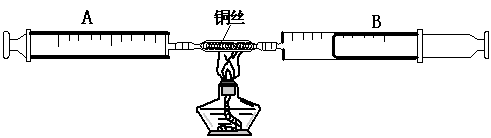
15.下图是由A、B两上注射器组成的密闭系统,其中存有30mL空气,给装有螺旋细铜丝的玻璃管加热,同时交替推动两个注射器的活塞,观察到的现象是
,发生反应的化学方程式为: 。
停止加热后冷却至室温,将气体全部推至B注射器中,推测注射器B中气体的体积约为
mL(玻璃管的体积可以不考虑),你的结论 。
16.小林同学学习了气体甲烷后,提出了这样一个问题:“氢气、一氧化碳气体可以燃烧并且都能够还原氧化铜,甲烷也是一种可燃气体,它是否也能还原氧化铜?”老师把他提出的问题让同学们讨论,有的同学说“能”,有的同学说“不能”,小林倾向于“能”,他想通过实验来解决心中的困惑。
(1)他请教老师后知道,在实验室可以用加热无水醋酸钠和碱石灰的方法制取甲烷:
CH3COONa(钠)+NaOH(固)![]() CH4+Na2CO3,他组装这套甲烷发生装置应选择的仪器是
CH4+Na2CO3,他组装这套甲烷发生装置应选择的仪器是
。
(2)他采用下图装置做甲烷还原氧化铜的实验。实验中观察到黑色氧化铜粉末变为红色的物质,试管口有水生成仅通过该实验还不能验证的产物是 。他应如何验证这一产物? 。
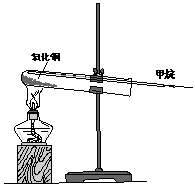
(3)写出甲烷还原氧化铜的化学方程式:
。
(4)天然气的主要成分是甲烷,它本身是一种无毒的可燃性气体。天然气的燃烧需要大量氧气。如果居民在使用灶具或热水器时不注意通风,室内的氧气会大量减少,造成天然气的不完全燃烧,其后果是产生有毒的一氧化碳,最终可能导致使用者中毒。写出天然气不完全燃烧的化学方程式: 。
17.小雪同学在实验室里将二氧化碳气体通入氢氧化钠溶液中,没有看到明显的实验现象她对二氧化碳能否与氢氧化钠溶液反应产生了疑问。你如何帮助该同学设计实验,验证二氧化碳和氢氧化钠溶液发生了反应?
| 验证思路 | 实验方法 | 实验现象 |
| 反应物中二氧化碳 已减少 |
| |
| 生成物中有
|
18.2004所6月5日世界环境日的主题是“海洋存亡,匹夫有责”。据报道,2004年5月,我国温州和烟台有数百平方公里近岸海域发生“赤潮”。环境专家指出,如果不采取措施,10年后渤海将变成死海。“赤潮”主要是指水中某些营养元素含量过高,导致海水中的藻类疯狂生长、过度繁殖,水质恶化,其他水生动植物因缺氧大面积死亡。
(1)发生“赤潮”的某海域的藻类中,其主要成分的化学式为C106H263O110N16P,则这种物质中所含元素名称分别是 ,由此推测,被污染的海水中导致藻类生长过快的营养元素是 。
(2)为了碧海蓝天,采取下列措施能有效防止海水“赤潮”现象的发生。请你结合实际,再列举三条合理建议。
A.水域沿岸人口密集区、工厂等要采用污水净化装置,保证污水达标排放。
B. 。
C. 。
D. 。
三.计算题:
19.人体内胃酸的主要成分是盐酸,胃酸过多,可引起一系列胃病。最近,美国食品与药品管理局批准胃酸完全抑制剂(Pepcid Complete)上市,作为治疗胃酸分泌过多的药品。该药品的标签如下图:
| 药品名称:胃酸完全抑制剂(Pepcid Complete) 主要成分:每片内含碳酸钙800mg和氢氧化镁116mg 作用用途:用于胃酸过多、烧心型消化不良等 用法、用量:口服,一次1片,每日2次 |
试通过计算说明,患者按处方服用该药一天,理论上可消耗HCl多少毫克?
