初三年级调研测试化学试卷
命题人:
说明:1.全卷共5页。考试时间90分钟,满分100分。
2.请将选择题的答案填在答题栏内,其它试题的答案答在试卷相应的位置上。
3.可能用到的相对原子质量:H-1,C-12,O-16,S-32,Cl-35.5,Ca-40,
N-14,Cu-64,Zn-65
第一卷 选择题(40分)
一.选择题(本题包括18小题,共40分。请将正确选项的编号填写在答题栏内)
以下第1~14题每小题只有一个选项符合题意,每小题2分,共28分。
1.下列变化不属于化学变化的是( )
A.食物腐败 B. 铜器表面生成铜绿
C.冬天烧炭烤火 D. 防毒面具中活性炭吸附毒气
2.臭氧(O3)在距地面10千米以上的高空形成臭氧层,臭氧层吸收了太阳光中绝大部分紫外线,使地球上的生物免受紫外线伤害。臭氧属于( )
A.混合物 B.氧化物 C.单质 D.化合物
3.实验室制取二氧化碳常用的方法是( )
A.煅烧石灰石 B.燃烧木炭
C.大理石跟稀盐酸反应 D.石灰石跟稀硫酸反应
4.交通警察通常用重铬酸钾试剂测试司机是否酒后开车。重铬酸钾的化学式是K2Cr2O7, 其中铬元素的化合价是( )
A.+5 B.+6 C.+7 D.+3
5.木炭、氢气、一氧化碳分别跟灼热的氧化铜反应,下列叙述正确的是( )
A.反应后都有水生成 B.反应后都有二氧化碳生成
C.反应后都有红色固体生成 D.都属于置换反应
6.下列实验现象叙述错误的是( )
A. 硫在氧气中燃烧发出蓝紫色火焰
B. 木炭在氧气中燃烧发出淡蓝色火焰
C. 铁在氧气中燃烧时火星四射
D. 一氧化碳在空气中燃烧发出蓝色火焰
7.下列操作方法中,不正确的是( )
A. 柴草、麦杆着火用水泼灭
B. 汽油着火用水浇灭
C. 实验桌上酒精着火用湿布扑灭
D. 熄灭酒精灯用酒精灯帽盖灭
8.极少青少年有吸烟的恶习,香烟的主要成份很复杂,经燃烧产生的烟气中含有许多强致癌物质和有害物质,其中对人体危害最大的是尼古丁(化学式为C10H14N2)、焦油、一氧化碳等,下列说法错误的是( )
A. 吸烟严重危害人的身心健康
B. 尼古丁由碳、氢、氮元素组成
C. C10H14N2中碳、氢、氮三元素的质量比为10:14:2
D. CO能与血液中的血红蛋白结合,故有毒
9.据有关资料显示,目前世界上有不少人患有缺铁性贫血。这里的铁是指( )
A.铁元素 B.铁单质 C.三氧化二铁 D.四氧化三铁
10.国际冰川专家最近指出:喜马拉雅山冰川按现在的消融速度至2035年将全部融化,与这种现象相关密切的气体是( )
A.CO2 B.SO2 C.CO D.NO2
11.水的污染原因有如下说法:①工业生产中废渣、废液的任意排放;②城市生活污水的任意排放;③农业生产中农药、化肥的任意施用;④雨水与土壤接触;⑤冰川融化。其中正确的是 ( )
A.①②③④ B.①②③④⑤ C.④⑤ D.①②③
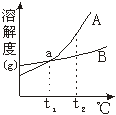 12.右图是A、B两种固体物质的溶解度曲线,下列说法中正确的是 ( )
12.右图是A、B两种固体物质的溶解度曲线,下列说法中正确的是 ( )
A.A物质的溶解度大于B物质的溶解度;
B.t1℃时,a点表示A、B两种物质的溶解度相等;
C.t2℃时,A、B两种物质的饱和溶液中溶质质量分数相等;
D.t2℃时,A物质溶液的溶质质量分数小于B物质。
13.下列说法正确的是( )
A. 一定温度下,同种物质的饱和溶液比不饱和溶液所含的溶质多
B. 同种物质的饱和溶液一定比不饱和溶液的浓度大
C. 一定量溶剂里不能再溶解某种物质的溶液,叫做这种物质的饱和溶液
D. 某物质的饱和溶液,当温度升高时,若溶液质量不变,该溶液溶质的质量分数不变
14.含有相同质子数的两种粒子的下列判断中,错误的是( )
A. 可能属于同一元素
B. 可能是两种不同的分子
C. 可能是一种离子或一种分子
D. 不可能是两种不同的离子
以下第15~18题的4小题每小题3分,共12分,每小题可能有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确时给3分,但只要错选一个,该小题为0分。
15. 有40克质量分数为5%的CaCl2溶液,若将其质量分数增大到10%,应采用的方法是( )
A.蒸发掉一半溶剂 B. 加入2g CaCl2
C.蒸发掉20g溶剂 D. 加入40克溶质质量分数为15%的CaCl2溶液
16.有A、B两种元素,已知A元素原子的核电荷数为a,A2-与Bn+的核外电子排布相同,则B元素原子的核电荷数为( )
A.a+n+2 B. a+n-2 C. a-n+2 D. a-n-2
17.在密闭容器中,7.2克碳与一定量氧气恰好完全反应,生成的气体的质量可能是( )
A.8.4克 B.16.8克 C.26.4克 D.44.0克
18. 甲、乙两种化合物都只含X、Y两种元素,甲、乙中所含X元素的质量分数分别为30.4%和25.9%。已知甲物质的化学式为XY2,则乙物质的化学式为( )
A.XY B. X2Y C. X2Y3 D. X2Y5
第一卷 答题栏(40分)
一.选择题答题栏(1~14每题2分;15~18每题3分;共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第二卷(60分)
![]() 二.填空题(本题包括7小题,共24分)
二.填空题(本题包括7小题,共24分)
19.(3分)某元素A的粒子结构示意图为 该粒子是__________ (填原子、阳离子或阴离子);该元素原子第二电子层有________个电子;该元素为__________元素(填“金属”或“非金属”)。
20.(4分)用化学符号表示:
1个硫原子__________; +2价的镁元素___________;
3个氢氧根离子___________; 4个氧分子__________;
21.(4分)发令枪打响后会产生白色烟幕。火药纸里的药粉主要成分有氯酸钾、催化剂和发烟剂红磷等物质。发令枪打响时产生氧气的反应方程式是:________________________,红磷剧烈燃烧产生白烟的反应方程式是:________________________________________ 。
22.(3分)NO是大气的主要污染物之一,近几年来,又发现在生物体内存在少量的NO,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。
(1)NO是工业制硝酸的中间产物,生成NO的化学方程式为:
根据质量守恒定律推出X的化学式为________________。
(2) 汽车尾气中含有NO、CO等有毒气体,治理的方法是在汽车排放尾气的排气管上装一个催化转换器,在催化剂的作用下,NO与CO反应生成参与大气生态循环的两种无毒气体。此两种气体是:________________________。
 23.(4分)铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。请列举铝在日常生活中,须加以控制使用的例子(最少填写三种):________________________________________________
23.(4分)铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。请列举铝在日常生活中,须加以控制使用的例子(最少填写三种):________________________________________________
__________________________________________________。
24.(2分)某课外研究小组研究右图实验,回答下列问题:
(1)哪个装置中的铁钉最先生锈?_________。
(2)通过这个实验得出铁钉生锈的条件是:
____________________________________________________。
25.(4分)分离混合物或提纯某些物质时,常用到①溶解,②蒸发结晶,③冷却结晶,④过滤等操作方法,请选择适当的操作方法的序号填空;
(1) 除去ZnSO4溶液中的水_________________________
(2) 除去石灰水中的CaCO3_________________________
(3) 除去KNO3固体中混有的少量NaCl_______________________
(4) 粗盐提纯_________________________________
三.实验题(本题包括2小题,共23分)
26.(8分) 有同学测定粗盐(含CaCO3杂质)中的氯化钠的质量分数,试回答:
(1)称取样品ag:称量前,首先调整托盘天平的零点,若天平的指针偏向左边,就将右边的螺丝向(左、右)________旋转。
(2)溶解:在粗盐溶解过程中,用玻璃棒不断搅拌,其作用是___________。
(3)过滤:在液体过滤的操作中,要使液体沿着______________缓缓流进过滤器,漏斗里的液面一定要低于______________,漏斗的下端管口要________________。
(4)蒸发:加热蒸发时用到的仪器有①_____________;②_____________;
③_____________;④_____________。
(5)计算:准确称量得纯净氯化钠为mg,则计算粗盐中氯化钠质量分数的数学表达式为______________。
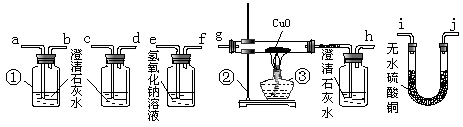 |
27.(15分)石油资源紧张曾是制约汽车工业发展,尤其是制约轿车进入家庭的重要因素之一。据报道,现有人研究“车用甲醇汽油”(甲醇的化学式为CH3OH)作汽车动力能源。
(1)指出上图中带标号的仪器名称:①__________;②__________;③__________。
(2)写出甲醇完全燃烧的化学方程式:____________________________________。
(3)甲醇燃烧时如果氧气不足,可能还有CO生成。用上述装置确证甲醇燃烧产物有CO、CO2、H2O,应将甲醇燃烧产物依次通过( )→( )→( )→( )→( )→( )→( )→( )→( )→( )(按气流从左至右顺序填写接口字母)。
(4)简述上述装置中的三瓶澄清石灰水的作用:
______________________________________________________;
______________________________________________________;
______________________________________________________。
(5)反应的尾气应如何处理?_______________________________。
(6)若甲醇燃烧产物CO、CO2、H2O的总质量为22.4g,将其通过浓硫酸,质量减少10.8g。则参加反应的甲醇为_________ g,产物中CO为___________ g。
四.计算题(本题包括2小题,共13分)
28.(3分)葡萄中含有丰富的白藜芦醇(化学式为C14H12O3),它具有抗癌性,能抑制癌细胞的增生。求:
(1) 白藜芦醇的相对分子质量
(2) 白藜芦醇中碳、氢、氧元素的质量比
29.(10分)下图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请认真阅读后计算:

(1) 该硫酸未开启前质量为_______克(盛装的瓶子除外);其中溶质的质量为_______克.
(2) 欲配制500克溶质质量分数为19.6%的稀硫酸,需这种硫酸多少毫升?(计算结果保留一位小数)
(3) 把(2)中配成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?