|
相对原子质量:Ca: 40 H : 1 Cl : 35.5 S : 32 Na:23 O:16
一. 选择题:(每题只有一个正确答案 )(共10分)
1.下列各组物质的名称、俗称和化学式表示同一物质的是 ( )
A、氧化铁、铁锈、Fe2O3 B、氢氧化钠、烧碱、Na2CO3
C、氢氧化钙、消石灰、Ca(OH)2 D、氢氯酸、盐酸、HClO3
2.下列物质中既是含氧酸,又是二元酸的是 ( )
A..盐酸 B.硫酸 C.磷酸 D.氢硫酸
3.在氯化铜和氯化镁的混合溶液中加入过量的锌粉,充分反应后过滤,留在滤
纸上的物质是 ( )
A.锌 B.铜 C.铜和镁 D.锌和铜
4.下列说法中正确的是 ( )
A、电离时能生成氢离子的化合物是酸
B、 电离时生成的阴离子全部是氢氧根离子的化合物叫碱
C、 盐电离出的阳离子一定是金属离子
D、 酸碱盐都是含氧的化合物
5.同质量同质量分数的NaOH溶液和HCl溶液混合,向所得的溶液中滴入石蕊
试液会 ( )
A.变蓝色 B.变红色 C.不变色 D.变无色
6.以Fe2O3、稀H2SO4、KOH溶液、Ba(NO3)2溶液、CuCl2溶液为反应物,两两间可发生的反应有 ( )
A、3个 B、4个 C、5个 D、6个
翰林汇.鉴别NaOH溶液、Ca(OH)2溶液和稀硫酸,可选用的试剂是 ( )
A、酚酞试液 B、石蕊试液 C、碳酸钠溶液 D、 盐酸
8.今有失去标签的氯化钡、碳酸钠、氯化镁三种溶液,要求只选一种试剂把它们鉴别出来,这种试剂是 ( )
A、硝酸银溶液 B、稀硫酸 C、硫酸钠 溶液 D、氢氧化钠溶液
9.翰林汇101010下列各组气体可用火碱干燥的是 ( )
A、H2、O2、N2 B、CO、SO2 、H2 C、CO2、HCl、N2 D、CO、CO2 O2
10.适量的①CaO ②CaCO3 ③Ca(OH)2三种固体物质分别与100g10%的稀盐酸恰好完全反应,所得溶液的质量分数大小关系正确的是 ( )
A、①=②>③ B、①>②>③ C、①>②=③ D、③>②>①
二、选择题(一个或两个正确答案 )(每题2分 共10分)
1. 下列物质在空气中放置一段时间后质量增加且变质的是 ( )
A.浓硫酸 B.生石灰 C.烧碱 D.浓盐酸
2.下列各组中的物质,只用水就能鉴别出来的是 ( )
A、固体:NaCl、KNO3、Ca(OH)2 B、气体:H2、O2、CO2
C、液体:植物油、酒精、浓硫酸 D、固体:CaCO3、CaCl2、CuSO4
3.不用其他试剂鉴别下列五种物质的溶液①H2SO4 ②FeCl3 ③Ba(OH)2 ④KCl⑤BaCl2,被鉴别出物质的顺序是 ( )
A.②①③⑤④ B.②③①⑤④ C.②③①④⑤ D.①③⑤②④
4.下列各组内物质的混合后,所得溶液一定呈酸性的是 ( )
A、KOH、 NaNO3、HCl B、BaCl2、 NaCl 、H2SO4
C、Ca(OH)2 、KNO3、Na2CO3 D、NaCl 、NaNO3 、KNO3
5.向氧化铜和铁粉的混合物中加入一定量的稀硫酸,充分反应后过滤,向滤液中插入铁片,有气泡产生,则下列说法中正确的是 ( )
A.不溶物中一定含有铜
B.滤液中一定含有硫酸铜
C.不溶物中可能含有氧化铜
D.滤液中一定含有硫酸亚铁
二填空题(每空1分)(共30分)
1.纯净的浓硫酸是________色、___________、___________的液体,______挥发,因为浓硫酸具有_____________性,所以常作____________剂。
2.稀释浓硫酸时,一定要把____________沿着器壁慢慢地注入__________里,并用_______________不断搅动,使产生的______________迅速地扩散,切不可______________________。
3.溶液的酸碱度用_________来表示,它的范围通常在____________之间,测定它的最简便的方法是用_____________。
4、石灰沙浆砌墙很牢固是因为 ,长期从膳食中摄入过量食盐会引起 。
5.下列物质:①烧碱 ②PH试纸 ③稀盐酸 ④熟石灰 ⑤浓硫酸 在生产生活中有广泛用途,请按以下要求填空。(填序号)可以除去水壶内水垢的是 。可用于测定土壤酸碱度的是 。农业上用来降低土壤酸性,改良土壤结构的是 。可用作某些气体干燥剂的固体物质是 。可用作某些气体干燥剂的液体物质是 。
6.要除去ZnSO4溶液里混有的少量硫酸溶液和硫酸铜溶液,可加入一种物质,它的化学式是 。
7、过氧化钠(Na2O2)是一种重要的物质,将Na2O2投入水中,可产生一种能使带火星的木条复燃的气体A,反应后溶液的pH大于7。试写出投入水中的发生反应的化学方程式 。Na2O2能吸收CO2气体而产生气体A,常用于潜水艇中作供氧剂,则此反应的化学方程式为 。
8、为了除去氢氧化钠溶液中的少量碳酸钠,可加入适量的 。化学方程式为 ,再经过 操作可得到纯净的氢氧化钠。
9、某学生发现家庭责任田中庄稼茎杆细软,抗病虫害能力差,出现了大面积倒伏等症状。他测定土壤溶液的PH=5,得知土壤呈 性。建议其父亲施用草木灰去改良土壤,增加肥力。由此可知草木灰属于 性物质,草木灰属于 肥。
四、写出下列化学反应的方程式(11分)
1. 不能用铝制品盛放农药波尔多液的原因是 ;
2.胃酸过多,常服含氢氧化铝的药物,原因是 ;
3.盐酸除铁锈 ;
4.氢氧化钠密封保存的原因 ;
5.氧化铜制备氢氧化铜 ;
;
6.下列各组物质中,都含有少量的杂质,只要求写除去杂质化学方程式
(l)CO(CO2) ;
(2)KCl(KClO3) ;
(3)KNO3(KCl) ;
(4)NaCl(Na2CO3) ;
(5)FeSO4(CuSO4) ;
五、简答题(27 分)
1.只用一种试剂鉴别下列物质,在横线上填所加试剂的化学式或名称
(l)BaCl2 NaCl K2CO3 ;
(2)NaNO3 MgCl2 (NH4)2SO4 ;
(3)CaCl2 NaNO3 H2SO4 ;
(4)NaCl H2SO4 Ca(OH)2 ;
2.有一包白色粉末,可能由碳酸钾,硫酸钾和氯化钾中的两种或三种组成。经实验得知,其中肯定含有碳酸钾,硫酸钾。为了确定是否含有氯化钾,某同学设计以下实验,请按该同学思路填表:
| 实验步骤 | 实验目的、现象、结论 |
| ①取少量白色粉末配成溶液,向其中加入足量的稀酸A,A为 , | 除去 , |
| ②继续加入足量的B,B为 溶液,过滤, | 除去硫酸钠, |
| ③向②的滤液中加入C,C为 溶液。 | 若有 生成,证明原粉末中肯定含有氯化钠,否则不含。 |
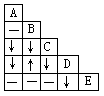 3、现有A、B、C、D、E五瓶未知溶液,它们是盐酸、硝酸钙、氯化钡、硝酸银、碳酸钠,将瓶内溶液各取少许进行两两混合实验,其结果如图所示。图中“↓”“↑”“-”符号分别表示生成沉淀、气体和无明显变化,据此分析,写出A、B、C、D、E所代表物质的化学式。
3、现有A、B、C、D、E五瓶未知溶液,它们是盐酸、硝酸钙、氯化钡、硝酸银、碳酸钠,将瓶内溶液各取少许进行两两混合实验,其结果如图所示。图中“↓”“↑”“-”符号分别表示生成沉淀、气体和无明显变化,据此分析,写出A、B、C、D、E所代表物质的化学式。
A________ B________ C________ D________ E________
4.有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠和硝酸钾中的某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤、得白色沉淀和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,沉淀不溶解。试根据以上现象推断该白色粉末中一定含有 ;一定没有 ;可能含有 。(填化学式)
5、有一包从海水中获得的粗盐,经过初步的提纯已不含不溶物。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
探究一 这包粗盐中还有什么杂质?
⑴根据海水的成分和初步提纯的实验操作,估计该粗盐可能还含有的杂质是CaCl2和MgCl2。
现实验验证这种推测:
取样并溶解,并加入适量NaOH溶液,目的是检验有没有 (填化学式);接着再加适量的Na2CO3溶液,目的是检验有没有 (填化学式)。
实验证明,这包粗盐中含有的杂质是CaCl2。
探究二 这包粗盐中 NaCl的质量分数是多少?
按下面步骤继续进行实验:
①称取一定质量的样品;
②将样品加水溶解,制成粗盐溶液;
③向粗盐溶液加入过量的某种试剂,过滤;
④沉淀洗涤后小心烘干,得到纯净固体A;
⑤滤液在进行某一操作后,移入蒸发皿,得到纯净固体B;
⑥称量实验中得到的某种固体。
⑵在②③⑤的步骤中,都使用到同一种仪器 (填名称);它在步骤②和⑤的操作方法相同,但目的不同,在步骤②中的目的是 ,在步骤⑤的目的是 。
⑶步骤③中加入的试剂是 ,步骤⑤进行的“某一操作”是 ,目的是 ;
⑷ 步骤⑥中,你认为需要称量的固体是A还是固体B (填A或B),你不选择称量另一种固体的理由是
。
六、计算题(12分)
1、 右图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:
右图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:
⑴该硫酸试剂未开启前质量为 g(盛装的瓶子除外);其溶质的质量为 g;
⑵欲配制500g溶质质量分数为19.6%的稀硫酸,需这种硫酸多少毫升?(计算结果保留一位小数)
⑶把⑵中配制的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?
2、有一瓶敞口放置过的氢氧化钠固体。取出60克该固体,烘干后质量为50.6克,再与足量稀盐酸反应,生成气体4.4克,试回答:固体中氢氧化钠的质量?反应后的溶液中含有氯化钠的多少克?