初三化学中考模拟试卷二
考试时间:90分钟;本卷总分100分
相对原子质量 H:1;C:12;O:16;Na:23;S:32;Cl:35.5;Ca:40;Fe:56;
Cu:64;Zn:65。
第一部分 选择题(共44分)
一、我能选择(每小题只有一个选项符合题意。每小题2分,共30分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | ||||||||
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答 案 |
1、下列自然现象存在化学变化过程的是
A、频繁发生沙尘暴天气的过程 B、大气污染物形成酸雨的过程
C、地球极地冰山融化的过程 D、温室气体使地球气温上升的过程
2、下列物质中属于纯净物的是
A、新鲜的空气 B、澄清石灰水 C、纯净的矿泉水 D、液态氧
3、工业上氯化氢常用氢气和氯气化合的方法制取,保持氯化氢化学性质的微粒是
A、H2 B、Cl2 C、H和Cl D、HCl
4、下列物质中带点元素的化合价是+3的是
A、一种净水剂KAl(SO4)2•12H2O B、自来水厂用来消毒杀菌的物质HClO
C、一种化肥NH4HCO3 D、食盐中常常添加的物质KIO3
5、俄罗斯科学家最近合成了原子序数为114的元素,经测定该原子的相对原子质量为289,则该元素的原子的核外电子数为
A、289 B、114 C、403 D、175
6、O2和CO2在性质上的相似点是①都具有氧化性;②都具有还原性;③都易溶于水;④都能跟碳反应;⑤都是气体;⑥都是氧化物;⑦都可用于灭火;⑧通常状况下密度都比空气大
A、①④⑤⑧ B、①②③④⑤⑥⑧ C、①④⑤⑦⑧ D、②④⑤⑧
7、某反应的生成物是一种单质和一种化合物,下列关于该反应的说法不正确的是
A、可能是分解反应 B、可能是复分解反应
C、肯定不是化合反应 D、可能是置换反应
8、下列做法不合理的是
A、盐场利用日光和风力使水分蒸发得到食盐
B、KNO3的饱和溶液升高温度后,溶质的质量分数不变。
C、用饱和食盐水溶液洗去食盐中含有的少量CaCl2和MgCl2
D、用降温结晶的方法除去NaCl中少量的KNO3
9、检验某化合物是否含有碳、氢、氧三种元素,在该物质燃烧后还必须进行的是①用带火星的木条检验;②用无水硫酸铜检验;③用澄清石灰水检验;④称量反应物与生成物
A、①②③④ B、①②③ C、②③④ D、②③
10、一些食物的近似pH如下:葡萄3.3~4.4;苹果2.9~3.3;牛奶6.3~6.6;鸡蛋清7.6~8.0,则下列说法中正确的是
A、胃酸过多的人应多食苹果 B、葡萄汁能使紫色石蕊试液变红
C、牛奶和鸡蛋清为碱性食品 D、苹果汁的酸性比葡萄汁弱
11、X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中含量仅次于Y,W可以形成自然界最硬的单质,下列叙述中错误的是
A、WX4是沼气的主要成分 B、固态X2Y有分子构成
C、WY2可用于灭火 D、ZY2可溶于水
12、某课外兴趣小组利用废铜制取硫酸铜,设计方案如下
![]() ①Cu → CuO → CuSO4
①Cu → CuO → CuSO4
②Cu →CuSO4
③Cu → CuSO4(Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O)
④Cu → Cu(NO3)2 → Cu(OH)2 →CuSO4
请从理论、操作、环保等方面考虑,你认为其中最合理的是
A、① B、② C、③ D、④
13、下列括号中的物质是某同学除去杂质所用的试剂,其中合理的是
A、NaCl中混有少量的Na2CO3[HNO3] B、CO2中混有少量CO[Ca(OH)2]
C、KNO3中混有少量的 CuSO4[Ba(OH)2] D、Fe粉中混有少量的CuO[HCl]
14、在AgNO3溶液中加入一定量的铁粉和铜粉,充分反应后过滤,向滤液中滴加稀盐酸,有白色沉淀生成,下列说法正确的是
A、滤液中一定有Fe2+、Cu2+、Ag+ B、沉淀中一定有Cu粉和Ag粉
C、滤液中可能含有Cu2+ D、AgNO3一定有剩余,Fe、Cu粉可能有剩余
15、下列错误操作中,通常使取得量或测得的数据偏小的是
A、用量筒取10mL水,采用俯视方法取得的量
B、用量筒测定液体体积,采用俯视方法测得的数据
C、将砝码放在左盘,不使用游码,称量右盘物质的质量,测得的质量数据
D、把配制好的一定质量分数的溶液,倒入试剂瓶时溅出少量。
二、我能选择(本题包括5小题,每题有1~2答案正确,错选或多选均不给分,漏选且所选答案正确给1分,每题2分,共10分)
| 题 号 | 16 | 17 | 28 | 29 | 20 |
| 答 案 |
16、2004年4月12日是第15个“世界地球日。”我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是
A、采用“绿色化学工艺”,使原料尽可能转化为所需要的物质。
B、大量开采地下水,以满足社会对水的需求。
C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃。
D、节约能源,提高能源利用率。
17、CO和CO2的混合气体含碳元素30%。取此混合气体4g,先通过足量灼热的氧化铜后,再将气体通入足量澄清石灰水中,得到白色沉淀的质量最多为
A、10g B、12g C、15g D、24g
18、1919年,Langmuir提出等电子原理:原子数相同,电子总数相同的分子,互称为等电子体。等电子体的结构相似,物理性质相似。根据上述原理,下列分子互为等电子体的是
A、N2、CO B、H2O、HF C、NH3、CH4 D、SO2、O3
19、下列各组溶液,不加其他试剂就能鉴别的是
A、Na2CO3、H2SO4、HCl、NaNO3 B、NaOH、NaCl、MgCl2、FeCl3
C、K2SO4、Na2CO3、BaCl2、HNO3 D、HCl、AgNO3、HNO3、MgCl2
20、某混合物经高温灼烧产生一种能使澄清石灰水变混浊的气体,若在灼烧的残渣中滴入稀盐酸,则残渣完全消失,并放出一种能使金属氧化物发生还原反应的单质气体,则该混合物的组成可能是
A、含有Fe2O3、CuO、C B、含有Fe2O3、C
C、含有CaCO3、Fe2O3、C D、含有CaCO3、CuO、C
第二卷 非选择题(共60分)
三、我能填空(每空1分,共25分)
21、用化学符号填空
⑴人体中含量最多的金属元素 ⑵天然气的主要成分
⑶由氮、氢、氧组成的酸 ⑷碘酒中的溶剂
22、用学过的化学式填空
厨房内调味的有机物 ;洗去试管中不溶性的碱常用 ;
制肥皂用到的一种碱 ;改良酸性土壤用到的物质 ;
常见的复合肥料 ;配制波尔多液用的盐的晶体 。
23、分别使用酸、碱、盐各一种除去变质烧碱中的杂质(用化学方程式表示)
⑴
⑵
⑶
24、控制城市汽车尾气对空气造成的污染的方法是 (填序号)
①开发氢能源;②植树造林;③带呼吸面具;④使用电动车
25、与金属跟盐反应的规律相似,非金属也有这样的规律,即活泼的非金属单质可以把较不活泼的非金属单质从盐溶液中置换出来。Br2、I2、Cl2及其化合物间有如下关系:
Br2+2NaI=2NaBr+I2,Cl2+2NaBr=2NaCl+Br2;由此推知,非金属单质Br2、I2、Cl2的化学活动性由强到弱的顺序为 ,Cl2与KI反应的化学方程式为
。
26、某无色溶液中,可能含有H+、Ag+、Cu2+、Na+、OH-、Cl-、NO3-、CO32-等8种离子中的几种,取该溶液少许,滴入几滴石蕊试液,石蕊试液变红,则原溶液中肯定没有的离子是 ,如原溶液中有Cl-,则原溶液中存在的离子是 。
27、已知乙炔(C2H2)是一种非常重要的有机物,实验室常用电石(主要成分是CaC2)和水反应制得乙炔和一种常见的碱,写出该反应的化学方程式 ,若让你选择发生装置,你认为应选择 (填“制CO2”或“用加热高锰酸钾制O2”),乙炔是一种具有可燃性,不溶于水的气体,你认为应选取 方法收集乙炔。
28、已知金属的活泼性可以通过其与酸和水反应的剧烈程度进行判断,活泼性越强,反应越剧烈。金属Na能与冷水剧烈反应,而Mg不能;金属Mg可以与热水反应,而Al不能;据此判断这三种金属的活泼性 ;又知碱性的强弱与其中金属元素的活泼性有关,金属活泼性越强的碱性越强,写出NaOH、Mg(OH)2碱性由强到弱的顺序 。
29、过氧乙酸(C2H4O3)是抗SARS时所用的高效消毒剂,已知过氧乙酸是一种具有较强的氧化性和酸性,能否对放有金属仪器的实验室消毒?(2分)
。
四、我能推断(每空1分,共8分)
30、现有两包样品,若取少量分别溶于水得甲、乙两溶液,它们中的溶质是由KNO3、FeCl3、Fe2(SO4)3、NaNO3、NaOH、Na2SO4中的一种或几种组成,为确定其组成,有人进行了下图所示实验(假设每步均恰好完全反应),试推测:

![]()
![]()
⑴A是 ,溶液丁中的溶质一定含有 ,溶液甲中一定不含
⑵若测定溶液甲中溶质只有FeCl3,则从原两包样品中各取少量混合,乙中一定含有有 。(写化学式)
⑶若溶液甲中不止一种溶质,则溶液乙中最多含 种溶质。
⑷甲最多含有 种,其组成是 (化学式,共2分)
五、我能实验(共22分)
31、室温时一般可采用 、 等方法加快固体物质的溶解速率。
32、检验某无色溶液是否是盐酸。
| 操 作 | 现 象 | 结 论 |
33、用10g含杂质10%的粗盐配制质量分数为10%的食盐溶液?(仪器、方法、用量)
⑴步骤:
⑵用到的玻璃仪器:
⑶所用到量筒应选取(填序号)
A、10mL B、50mL C、100mL D、250mL
34、有两个实验小组同学为探究过氧化钠与二氧化碳的反应,用如图所示的装置进行实验。通入CO2气体,将带余烬的木条插入试管C中,木条复燃。
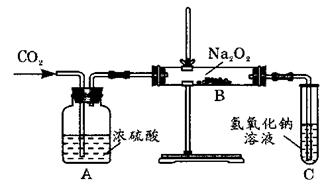
请回答下列问题:
(1)第一小组同学认为Na2O2与CO2反应生成了碳酸钠和氧气,该反应的化学方程式是
(2)请设计一种实验方案,证明过氧化钠与二氧化碳反应生成白色固体中含有碳酸钠,
(3)第二小组同学认为Na2O2与CO2反应除了生成碳酸钠和氧气外,还有氢氧化钠和硫酸钠生成,请你从化学反应的实质上说出你同意或不同意他们的理由
35、绘出符合要求的简易的装置图。
用大理石和稀盐酸制取二氧化碳,请设计一个可随时控制反应发生和停止的制备装置。
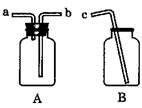 36、NO是汽车尾气中的一种大气污染物,它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应而生成红棕色的NO2气体。采用如图所示的仪器A和B及胶皮管组成装置收集一氧化氮气体(①仪器A已经气密性检查;②除水外不用其它试剂)写出正确的操作步骤。
36、NO是汽车尾气中的一种大气污染物,它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应而生成红棕色的NO2气体。采用如图所示的仪器A和B及胶皮管组成装置收集一氧化氮气体(①仪器A已经气密性检查;②除水外不用其它试剂)写出正确的操作步骤。
六、我能计算(共5分)
38、某样品为Cu和CuO的混合物,为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一种样品分别进行实验,测得的数据如下表:
| 学 生 物 质 质 量 | 甲 | 乙 | 丙 | 丁 |
| 所取固体样品的质量(g) | 30 | 25 | 20 | 20 |
| 加入硫酸溶液的质量(g) | 100 | 100 | 100 | 120 |
| 反应后剩余固体的质量(g) | 22 | 17 | 12 | 12 |
分析实验数据,回答下列问题:
⑴写出氧化铜与硫酸反应的化学方程式
⑵求混合物中氧化铜的质量分数。
⑶求硫酸溶液中溶质的质量分数。