初三化学中考模拟题(四)
(时间40分钟,满分40分)
一、选择题(每小题2分,共10分)
1.下列变化属于化学变化的是[ ]
A.冰雪消融 B.钢铁生锈 C.轮胎爆炸 D.铜丝导电
2.“84消毒液”的有效成分是次氯酸钠(NaClO),其中Cl元素的化合价为[ ]
A.-1 B.+1 C.+3 D.+5
3.工业上将焦炭转化为水煤气的反应为:C+H2O![]() CO
+H2,该反应中的还原剂是[ ]
CO
+H2,该反应中的还原剂是[ ]
A.C B.H2O C.CO D.H2
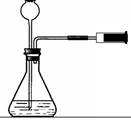 4.可用推拉注射器活塞的方法检查图中装置的气密性。当缓慢拉活塞时,如果装置气密性良好,可观察到
4.可用推拉注射器活塞的方法检查图中装置的气密性。当缓慢拉活塞时,如果装置气密性良好,可观察到
A.长颈漏斗下端口产生气泡 B.瓶中液面明显上升
C.长颈漏斗内有液面上升 D.注射器内有液体
5.小华将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写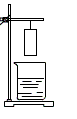 “化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是
“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是
|
| A | B | C | D |
| 滤纸上的指示剂 | 酚酞试液 | 酚酞试液 | 石蕊试液 | 石蕊试液 |
| 烧杯中的溶液 | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
二、填空题(本题包括 7小题,共22分)[ 提示:战胜自我,向粗心要分!]
6.(2分)用符号和数字表示:(1)2个铜离子 (2)3个二氧化氮分子
![]()
7.(2分)根据下列微粒结构示意图
用编号回答:表示阳离子的是 ;易得到电子的是 。
8.(3分)液晶是一类新型材料,广泛用于电子、仪表产品等。MBBA是一种研究较多的液晶材料,其化学式为C18H21NO。
(1)MBBA的相对分子质量为 。
(2)MBBA中含有 种元素;1个MBBA分子中含有 个原子。
9.(5分)在C、O2、H2、CO、Ca(OH)2五种物质中(填化学式):可用作高能燃料,且燃烧产物不污染环境的是 ;能使带火星的木条复燃的是 ;既有可燃性又有还原性的固态单质是 ;具有毒性的是 ;农业上用于降低土壤酸性的是 。
10.(4分)根据下列要求,选择H、O、C、S、Na五种元素中的两种或多种组成相应的物质,用化学式填空:
(1)打开汽水瓶时,大量逸出的气体 (2)一种常用的强碱
(3)含氧50%的氧化物 (4)一种最简单的有机化合物
11.(5分)按要求完成化学方程式:
(1)除去KNO3溶液中混有的少量K2SO4 。
(2)热水瓶胆壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁),可加入适量的盐酸把它除掉。发生的化学反应方程式为 ;
。厨房中的食醋,也可除水垢,这主要是利用食醋中含有的乙酸(CH3COOH)具有酸性,CH3COOH可用HAc表示,如:与氢氧化镁的反应可表示为2HAc+Mg(OH)2==Mg(Ac)2+2H2O。则醋酸与水垢中CaCO3反应的化学方程式为 。
12.(1分)已知含-1价的氢的化合物[如氢化钠(NaH)]与水接触生成相应的碱和氢气。则氢化钙与Na2CO3水溶液反应的方程式为 。
三、推断题(本题共2小题,请选做其中一题,共8分)
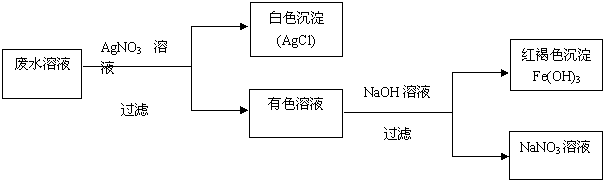
13.某校化学兴趣小组对一种工业废水溶液按下列步骤进行实验(假设能发生的反应均完全):
根据以上实验事实,用化学式回答:
(1)当废水溶液中仅含一种溶质时,该溶质是 。
(2)当废水溶液中含多种溶质时,除上述(1)中溶质外,还可存在的盐是 、 、 ,以及其它可能存在的溶质是 、 。
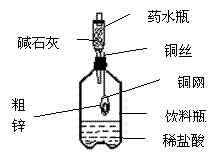 14.某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验。请帮助完成下列实验报告。
14.某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验。请帮助完成下列实验报告。
(一)实验目的:测定 。
(二)实验用品:托盘天平、药水瓶、铜网、铜丝、饮料瓶。粗锌、稀盐酸、碱石灰(CaO和NaOH)。
(三)实验步骤
| 实验内容和步骤 | 实验现象 | 结论(或化学方程式) |
| ①称量10.0g粗锌放在铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g | ∕ | ∕ |
| ②将铜网插入足量稀盐酸中,充分反应 |
| 发生的化学方程式:
|
| ③反应完全后,称得装置总质量为119.8g | ∕ | 产生H2的质量为 g。 粗锌的纯度为 。 |
(四)问题探究:
说明:不考虑空气中CO2、和H2O 对实验的影响。
(1)该实验中碱石灰的作用是 ,若去掉碱石灰,则所测定的粗锌纯度 (填“偏大”、“偏小”、“无影响”)。
(2)若只将粗锌换成石灰石,原实验方案能否用于石灰石样品纯度的测定 (填“能”或“不能”),理由是 。
(3)若将图中药水瓶改成直导管、粗锌换成纯锌,用原方案测定锌的相对原子质量,则结果 。(填“偏大”、“偏小”、“无影响”)
附加题:计算题(本题共1小题,6分)
15.在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐。这里的碱是指Na2CO3,盐是指NaCl。人们从盐湖中捞得的Na2CO3会含有少量的NaCl。
某研究性学习小组称取含NaCl的Na2CO3固体25.0g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到8.8g CO2气体。
(1)计算原固体中Na2CO3的质量分数和消耗盐酸的总质量。
(2)下表为研究性学习小组向上述所配制的混合液中分三次逐滴加盐酸后,所记录的部分数据。经查阅资料知:
(1)Na2CO3+HCl=NaCl+NaHCO3 (2) NaHCO3+HCl=NaCl+H2O+CO2↑
已知:反应(1)完全后,反应(2)才开始。
①请完成表格中未填的部分。
| 实验次序 | 每次产生的CO2的质量(g) |
| 第一次先逐滴加盐酸100g |
|
| 第二次再逐滴加盐酸100g | 8.8 |
| 第三次再逐滴加盐酸100g | 0 |
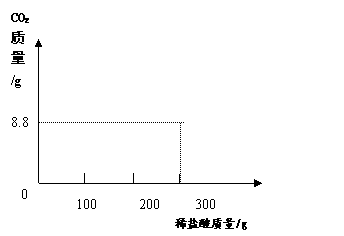 ②根据表中数据在坐标系中画出CO2质量(纵坐标)与所加入盐酸质量(横坐标)的关系图。
②根据表中数据在坐标系中画出CO2质量(纵坐标)与所加入盐酸质量(横坐标)的关系图。