初三化学第三章综合练习
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Al-27 S-32 Cl-35.5
K-39 Ca-40 Mn-55 Fe-56 Zn-65 I-127
一、 选择题(每小题只有一个选项是符合题意的)
1.下列有关的性质中,属于氢气化学性质的是 ( )
(A) 还原性 (B)挥发性 (C) 氧化性 (D) 难溶性
2.下列符号中能够表示两个氢分子的是 ( )
| (A) 2H | (B) H2 | (C) 2H+ | (D) 2H2 |
3.能够保持氢气化学性质的是 ( )
| (A) 2H+ | (B) H2 | (C) 2H | (D) 2H2 |
4.下列混合气体遇明火可能发生爆炸的是 ( )
| (A) H2和CH4 | (B) H2和N2 | (C)H2和CO2 | (D) H2和空气 |
5.在H2 +CuO![]() H2O + Cu 的反应中,下列说法正确的是 ( )
H2O + Cu 的反应中,下列说法正确的是 ( )
(A)氧化铜是氧化剂,故氧化产物是铜
(B)氧化铜失去氧的反应叫做还原反应,还原产物是铜
![]() (C)氢气是还原剂,所以还原产物是水
(C)氢气是还原剂,所以还原产物是水
(D)因水中含有氧,所以水是氧化剂
6.根据质量守恒定律判断,镁带在空气中完全燃烧,生成物的质量 ( )
(A) 大于镁带的质量 (B) 小于镁带的质量
(C) 等于镁带的质量 (D) 无法确定
7.化学反应前后,下列各项肯定不变的是 ( )
①原子数目 ②分子数目 ③元素种类 ④物质质量总和 ⑤物质种类 ⑥原子种类
| (A) ①②③⑤ | (B) ①②⑤⑥ | (C) ①③④⑥ | (D) ①②④⑥ |
8.取相同质量的高锰酸钾和氯酸钾,分别加热,若完全分解产生的氧气 ( )
(A)一样多 (B)高锰酸钾产生的氧气多
(C)氯酸钾产生的氧气多 (D)无法比较
9.现有5.6g不纯的铁块,跟足量的稀硫酸反应生成0.19g氢气,则此铁块中可能含有的
金属是 ( )
| (A) Zn | (B) Mg | (C) Ca | (D) Al |
10.将3g某物质在氧气中充分燃烧生成8.8g二氧化碳和5.4g水。由此可推断该物质的组成中
( )
| (A)只含有C、H两种元素 | (B)可能含有氧元素 |
| (C)一定含有氧元素 | (D)以上说法中均不正确 |
11.现将A、B两种物质各10g混合加热,A完全反应,生成8gC和4gD,则参加反应的A和
B的质量比是 ( )
| (A) 1:1 | (B) 2:1 | (C) 4:1 | (D) 5:1 |
12.某反应A + B![]() C + D 中,若25gA与10gB恰好反应,生成5gD。若有5gB完全反应,
C + D 中,若25gA与10gB恰好反应,生成5gD。若有5gB完全反应,
可生成C的质量是 ( )
| (A) 25g | (B) 15g | (C) 10g | (D) 5g |
13.在2XY + Y2![]() 2Z中,Z的化学式是 ( )
2Z中,Z的化学式是 ( )
| (A) XY2 | (B) X2Y | (C) XY3 | (D) X2Y3 |
14.下列化学方程式书写正确的是 ( )
| (A)C + O2 | (B)3Fe + 2O2 |
| (C)2P2 + O2 | (D)2Fe + 6HCl |
15.关于C+ O2![]() CO2含义的说法中,不正确的是 ( )
CO2含义的说法中,不正确的是 ( )
| (A) 碳和氧气在点燃的条件下发生化学反应,生成二氧化碳 |
| (B) 每12份质量的碳与32份质量的氧气反应,生成44份质量的二氧化碳 |
| (C) 每1个碳原子与1个氧分子反应,生成1个二氧化碳分子 |
| (D) 碳与氧气与二氧化碳的质量比为4:8:12 |
16.把mg氯酸钾与ng二氧化锰的混合物加热,过一端时间后得残留固体的质量为wg,则生
成氧气的质量为 ( )
| (A) (m-w)g | (B) (m-n-w)g | (C)( m+n-w)g | (D) (w-n)g |
17.能区分开氧气、氢气、二氧化碳和空气四瓶无色气体的简便方法是 ( )
| (A) 观察颜色状态并闻气味 | (B) 将四种气体分别通入灼热的氧化铜粉末 |
| (C) 将四种气体分别通入澄清的石灰水中 | (D) 将燃着的木条伸入四种气体中 |
18.将氢气通入盛有氧化铜粉末的试管中,加热使之反应,经一段时间停止加热,若有12g水
生成,则试管内剩余物质的质量比原氧化铜的质量减少 ( )
| (A) 10.67g | (B) 12.33g | (C) 16.2g | (D) 22.1g |
19.已知相同温度和压强下,气体的体积比等于分子个数比。若在空气中混入氢气的体积达到总体积的4.1% ~ 75%时,点燃就会发生爆炸,下面列出了氢气混入空气总体积的不同体积分数,其中爆炸最猛烈的是 ( )
| (A) 氢气占10% | (B) 氢气占29% | (C) 氢气占50% | (D) 氢气占70% |
20.某正二价金属与盐酸反应,生成a克氢气之后,它的质量减少了b克,则该金属的相
对原子质量为 ( )
![]()
21.将5.6g甲物质、9.6g乙物质、0.5g丙物质混合加热发生化学反应,经分析可知反应后混
合物中含2.8g甲、9.3g丙,还有新物质丁,已知甲、乙、丙、丁的式量为28、32、44、
18,若用甲、乙、丙、丁分别表示该物质的化学式,则它们之间反应的化学方程式可表
示为 ( )
| (A) 甲+乙=丙+丁 | (B) 甲+3乙=2丙+2丁 |
| (C) 2甲+乙=2丙+丁 | (D) 2甲+乙=丙+2丁 |
22.在化学反应xM +yN = mP + nQ 中,下列说法中正确的是 ( )
(A)若M、P为单质,N、Q为化合物,则该反应不一定是置换反应
(B)系数x与y的和不一定等于m与n的和
(C)若取agM和agN反应,生成P和Q的质量总和一定是2ag
(D)反应物M和N的质量比一定等于生成物P和Q的质量比
23.镁、铝、锌、铁四种金属分别跟足量的稀硫酸发生反应,能正确反映金属质量(x)和产
生氢气质量(y)之间关系的图象是 ( )
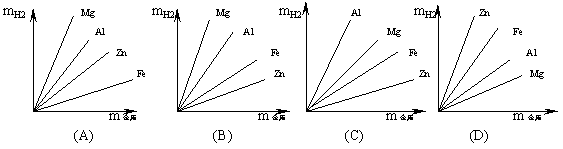
24.等质量的三种金属,它们和足量的稀硫酸完全反应后都生成+2价的硫酸盐(MSO4),其
产生氢气的体积与反应时间关系如图所示,则下列说法中正确的是 ( )
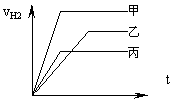
(A) 三种金属化学活动性大小为甲>乙>丙
(B) 反应消耗稀硫酸的质量一定相等
(C) 三种金属相对原子质量丙>乙>甲
(D) 反应速度最快的是甲,最慢的是丙
25.木炭在氧气中完全燃烧生成二氧化碳,下列叙述符合质量守恒的是 ( )
| (A) 4g木炭和8g氧气反应,生成12g二氧化碳 |
| (B) 8g木炭和4g氧气反应,生成12g的二氧化碳 |
| (C) 12g木炭和16g氧气反应,生成28g二氧化碳 |
| (D) 6g木炭和16g氧气反应,生成22g二氧化碳 |
26.4.9g氯酸钾和1.62g二氧化锰充分反应后,剩余固体的质量是 ( )
| (A) 1.62g | (B) 2.98g | (C) 4.6g | (D) 小于6.52g |
27.现代医学证明,人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着。碱式磷酸钙分子中
除钙离子外,还有一个氢氧根离子和三个磷酸根离子(PO43-)。则碱式磷酸钙的化学式为
( )
| (A) Ca2(OH)(PO4)3 | (B) Ca3(OH)(PO4)3 |
| (C) Ca4(OH)(PO4)3 | (D) Ca5(OH)(PO4)3 |
28.下列说法中,错误的是 ( )
| (A)“2Na+”表示两个钠离子 |
| (B) 甲醛(CH2O)是一种化合物 |
| (C)“笑气”(N2O)是一种麻醉剂,也是一种混合物 |
| (D) 锌跟稀硫酸的反应属于置换反应 |
29.下列有关氢气的实验中,其现象或操作叙述中正确的是 ( )
| (A) 氢气还原氧化铜,黑色的氧化铜变成光亮的紫红色铜,试管口有水生成 |
| (B) 纯净的氢气在空气中可以安静地燃烧,发出蓝色的火焰 |
| (C) 氢气还原氧化铜,实验结束时先熄灭酒精灯,最后将导管从冷的试管中取出 |
| (D) 制氢气时应先将药品放入试管中,在检查装置的气密性 |
30.用I2O5可测定空气中受CO污染的程度,发生反应的化学方程式如下:I2O5
+ 5 CO![]() I2 + 5CO2,据生成CO2的多少可判断CO的含量。关于这个反应,下列说法中正
I2 + 5CO2,据生成CO2的多少可判断CO的含量。关于这个反应,下列说法中正
确的是 ( )
| (A) 参加反应的I2O5的质量等于生成的CO2的质量 |
| (B) 参加反应的各物质中的氧原子总数等于生成的CO2中的氧原子总数 |
| (C) 反应物中所含元素种类与生成物所含元素种类不相同 |
| (D) 参加反应的I2O5和CO的质量比等于生成的I2和CO2的质量比 |
二、填空题
31.用化学符号表示:4个二氧化氮分子______________;负二价的氧元素_______________。
32.写出下列微粒中“3”的涵义:3Fe________________;O3(臭氧)____________________。
33.汽车尾气(含CO、NO等)是城市空气的污染源。治理的方法之一是在汽车的排气管上装
一个“催化转化器”(内含催化剂),它的特点之一是使其中CO与NO反应,生成可参与
大气生态环境循环的无毒气体氮气和二氧化碳。写出CO与NO反应的化学方程式:_____
_____________________________________________。
34.在反应A + B![]() C + D中,反应物A与B的质量比为5:2。若完全反应后生成的C和D
C + D中,反应物A与B的质量比为5:2。若完全反应后生成的C和D
共2.1g则消耗反应物A为____________g,B为________________g。
35.A![]() B + C + D C
B + C + D C![]() E + F B + E
E + F B + E![]() C + G
C + G
根据上述三个反应化学方程式,试推断化学式F:_____________;B:________________。
36.按要求填写下列表格:
| 物质 | 所含杂质 | 除去杂质的方法(用化学方程式表示) |
| 铜 | 氧化铜 | |
| 铜 | 锌 | |
| 氮气 | 氧气 |
37.写出下列各反应的化学方程式并指出基本反应类型:
| 化学反应 | 化学方程式 | 基本反应类型 |
| 镁在空气中燃烧 | ||
| 电解水 | ||
| 铁与稀盐酸反应 |
三、实验题
38.请看下列各图,并回答问题:
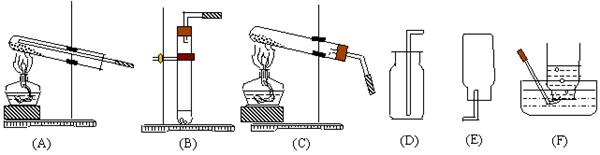
(1) 实验室制备氢气应选用的装置是___________,收集氢气可选用的装置是____________。
(2) 实验室制备氧气应选用的装置是___________,收集氧气可选用的装置是____________。
(3) 氢气还原氧化铜应选用的装置是____________和______________连接。
(4) 阅读下列短文:在通常状况下,硫化氢是一种没有颜色但具有臭鸡蛋气味的有毒气体,比空气重,能溶于水。在空气中硫化氢气体可以被点燃,有二氧化硫和水生成。硫化氢的实验室制法是:在常温下,用块状硫化亚铁和稀硫酸反应便可产生硫化氢气体。试回答:
a 具有臭鸡蛋气味,比空气重,能溶于水,这属于硫化氢的_______(填“化学”或“物理”性质)
b 制备硫化氢气体的发生装置可选用__________装置。收集时,应用装置__________。
c点燃硫化氢气体前应______________。硫化氢气体在空气中燃烧的化学方程式为______________________________。
四、计算题
39.用电解水的方法制氧气,若要获得3.2克氧气,需要电解多少克水?
40.将一定质量的氯酸钾和二氧化锰的混合物充分加热,待氯酸钾反应结束,收集标准状况下的氧气3.36升(标准状况下氧气的密度为1.429克/升),剩余固体物质的质量为12.45克。求原混合物的总质量是多少?
41.有7克含有杂质的金属锌,与足量的盐酸反应后,产生的氢气能与1.6克氧气完全化合。求该金属锌的纯度。
第三章参考答案
一、选择题
1.AD 2.D 3.B 4.D 5.B 6.A 7.C 8.C 9.A 10.A 11.D 12.B 13.A 14.B 15.D
16.C 17.D 18.A 19.B 20.C 21.B 22.B 23.B 24.C 25.D 27.D 28.C 29.C 30.B
二、填空题
31.4NO2 ;![]()
32.三个铁原子;每个臭氧分子是由三个氧原子构成的
33.2CO + 2NO![]() N2 + 2CO2
N2 + 2CO2
34.1.5;0.6
35.O2;CuO
36.H2 +
CuO![]() Cu + H2O
Cu + H2O
Zn
+ H2SO4![]() ZnSO4 + H2↑ (或HCl)
ZnSO4 + H2↑ (或HCl)
5O2
+ 4P![]() 2P2O4 (其他合理的给分)
2P2O4 (其他合理的给分)
37.2Mg + O2![]() 2MgO ; 化合反应
2MgO ; 化合反应
2H2O![]() 2H2↑+ O2↑; 分解反应
2H2↑+ O2↑; 分解反应
Fe+
H2SO4![]() FeSO4 + H2↑; 置换反应
FeSO4 + H2↑; 置换反应
38.(1)(B);(F)
(2)(C);(D);(F)
(3)(A);(B)
(4) a 物理
b (B);(D)
c 检验其纯度;2H2S + 3O2![]() 2SO2 + 2H2O
2SO2 + 2H2O
39.3.6g。
40.17.25g。
41.92.9%。