初三化学第七章单元学习质量检测
化学试卷
(80分钟,总分100分)
可能用到的相对原子质量:Zn—65 H—1 S—32 O—16 Na—23 C—12 Cl—35.5
一、选择题(每题3分,共10小题,且每题只有一个正确答案)
1.某同学的实验记录有如下数据,其中不合理的是……………………………… …… ( )
A.用pH试纸测得某溶液的pH值是9 B.用温度计测定某溶液的为35.5℃
C.用100ml量筒量取35.5ml盐酸溶液 D.用托盘天平称得5.5克NaCl固体
2.只用下列一种试剂来鉴别BaCl2(中性)、NaOH、H2SO4三种无色溶液,可选用的试剂有……………………………………………………………………………………… ……( )
①纯碱溶液; ②酚酞试剂; ③紫色石蕊试液; ④硫酸铜溶液; ⑤硝酸银溶液。
A.只有①③④ B.只有①②③④ C.只有 ①②③ D.①②③④⑤
3.对下列实验现象描述正确的是……………………………………………………… …( )
A.氯化铜溶液中加入铁粉后,溶液颜色变为无色
B.硫酸铵中加入氢氧化钠溶液后,微热有无色无味的气体生成
C.硫酸铜溶液中滴加氢氧化钾溶液时,有蓝色沉淀产生
D.氢氧化钠溶液遇无色酚酞试液变红色
4.某同学想用实验证明硫酸铜溶液显蓝色与SO42—无关,只进行下列实验无意义是 ( )
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
5.食盐、食醋和纯碱均为厨房中常用的物质,利用这些物质能完成的实验是…… ……( )
①检验自来水中是否含有氯离子 ②鉴别食盐和纯碱
③检验鸡蛋壳是否含有碳酸钙 ④除去热水瓶中的水垢
A.①② B.①③ C.①④ D.②③④
6.向AgNO3、Cu(NO3)2的混合溶液中加入一些铁粉,完全反应后过滤。不可能存在的情况是…………………………………………………………… ……………………………( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+ B.滤纸上有Ag、Cu,滤液中有Cu2+、Fe2+
C.滤纸上有Ag、Cu、Fe,滤液中有Ag+、Cu2+ D.滤纸上有Ag、Cu、Fe,滤液中有Fe2+
7.某河道两旁有甲、乙两工厂,它们排放的工业废水中,主要含有H2SO4、Ba(NO3)2、Cu(NO3)2、NaOH四种物质,且甲、乙两工厂排放的废水中所含物质各不相同。若取甲厂排放的废水样品,并滴入无色酚酞试液,发现变红色。则下列有关的叙述中不正确的是( )
A.取乙厂排放的废水,并滴入紫色石蕊试液,会变红色
B.取乙厂排放的废水,并加入氢氧化钠溶液,会产生蓝色沉淀
C.取甲厂排放的废水,并滴入纯碱溶液,会产生白色沉淀
D.取甲厂排放的废水,并加入尿素固体混合加热,会产生使湿润红色石蕊试纸变蓝的气体
8.下列各组物质之间能发生反应,且生成+3价铁盐的是………………………………( )
A.Fe和稀硫酸 B.Fe2O3和稀硫酸
C.FeCl2溶液和硝酸银溶液 D.Fe2(SO4)3和水
9.现有甲、乙、丙、丁4瓶无色溶液,分别是稀盐酸、稀硝酸、氢氧化钠溶液、氢氧化钡溶液中的一种。通过下图所示的实验过程可以将它们一一鉴别。其中所加试剂X可能是( )
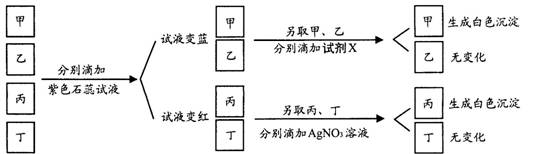
A.稀HCl B.Cu(NO3)2溶液 C.Na2SO4溶液 D.NaCl溶液
10.在一定量的稀硫酸中加入足量的锌粒,下列图像中正确的是………………………( )
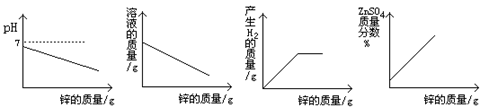
A B C D
二、(14分)对复分解反应的理解和应用。
11.复分解反应是我们学过的化学基本反应类型之一。学习时,应注意将知识进行归纳、总结,与其他三种基本反应相联系,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)(4分)请写出两个属于复分解反应,且有气体生成的化学反应方程式(两个反应中的气体不同)。
_______________________________________、________________________________________
(2)(4分)你想过复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如氯化钡溶液与硫酸钠溶液反应,实际参加反应的离子是Ba2+和SO42-,而Cl-和Na+则是“旁观者”,并没有参加反应。请你分析:①碳酸钾溶液与稀盐酸混合后实际参加反应的离子是______________(填离子符号,下同);②氢氧化钡溶液与稀硝酸混合后实际参加反应的离子是______________。
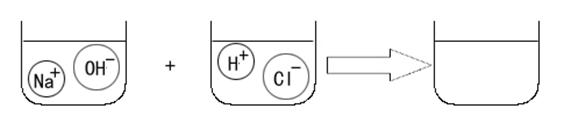 (3)(2分)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。
(3)(2分)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。
(4)(4分)请写出能生成水,但反应类型不同的四个化学方程式。
①化合反应____________________________②分解反应________________________________
③置换反应____________________________④复分解反应______________________________
三、(11分)仔细思考,回答下列有关的问题。
12.(1)(2分)经查阅:Cu+2FeCl3=2FeCl2+CuCl2,由此,有些同学根据金属与盐的反应的条件,得出Cu的活动性比Fe强的结论,该同学的结论是否正确?_____,理由是____________。
(2)(2分)为了验证二氧化碳气体能与氢氧化钠溶液发生反应,某同学设计的方案:首先在氢氧化钠溶液中滴加几滴无色酚酞,然后向溶液中通入二氧化碳气体,根据酚酞是否变色来判断是否发生反应。该同学的方案是否正确?________,理由是_________________________。
(3)(2分)酸碱中和反应是一个放热反应。①为了证明其反应放热,有同学取40gNaOH固体加入到100g、36.5%且温度为12℃的浓盐酸中,充分反应后,测得溶液温度为20℃,由此断定该反应是放热反应。该同学的观点是否正确?_______,理由是______________________。
(4)(5分)某同学在加热条件下做硫酸铵[(NH4)2SO4]和氢氧化钠溶液反应的实验,发生反应的化学方程式为____________________________________________________,将红色石蕊试纸放在试管口未变蓝,可能是因为_____________________________。我市某研究性学习小组的同学为了证明郊区农田河水中是否含有铵盐,取少量河水于试管中,加入浓氢氧化钠溶后加热,发现没有氨气味。由此断定河水不含铵盐。这种方法是否正确?______(填“是”或“否”)。原因是______________________________________。
三、(14分)联系生活的实际问题。
13.(8分)2004年5月25日广州佛山市某地发生了一起亚硝酸钠中毒事件。亚硝酸钠外观酷似食盐且有咸味,亚硝酸钠和食盐的有关资料如下:
| 项 目 | 亚硝酸钠 (NaNO2) | 氯化钠 (NaCl) |
| 水溶性 | 易溶,在15℃时溶解度为81.5g | 易溶,在15℃时溶解度为35.8g |
| 熔 点 | 271℃ | 801℃ |
| 沸 点 | 320℃会分解,放出有臭味的气体 | 1413℃ |
| 跟稀盐酸作用 | 放出红棕色的气体NO2 | 无反应 |
(1)(4分)实验室有两包白色固体,一种是亚硝酸钠固体,一种是氯化钠固体。要鉴别这两种固体,可选用的试剂是____________或____________。
(2)(4分)请选用上述试剂中的一种来鉴别两包白色固体,完成下列实验报告。
| 实验步骤 | 实验现象 | 实验结论 |
14.(6分)某污水pH=5,主要含有碎叶、硫塑料薄膜、泥沙、少量氯化钠和硫酸钠等物质。现欲将其经过过滤处理后用于清洗厕所的用水。问:
(1)(2分)从耐腐蚀角度考虑,应选择何种材料制成的管子来引流这种污水__________(铁管、铝管、陶瓷管)。
(2)(4分)要判定经过滤后的水中是否还存在Cl—,检验的方法是:取少量污水先滴加过量的(写化学式,下同)___________溶液至无沉淀生成,然后继续往其中滴入________溶液和稀硝酸,观察有无白色沉淀生成。
四、(12分)对松花皮蛋的有关探究
15.松花皮蛋于明朝初年开始问世,距今已有500多年的历史。皮蛋的味道鲜美,略显碱性。腌制皮蛋的化学配方有多种,传统的方法是将灰料敷在鲜蛋外,灰料的主要原料一般包括生石灰、纯碱和食盐。用水调制灰料成浆糊状的碳酸钙悬浊液,敷在蛋上,密封保存,数天后即可食用。
(1)(1分)刚吃皮蛋的人会发现皮蛋有点涩口,所以在吃时常常喜欢添加一点醋。其主要的原因是_________________________________________________________________________。
(2)小明同学根据上述信息,进行了自制皮蛋的历程。
①(4分)向烧杯中加入腌制皮蛋的灰料,再加入适量的水,搅拌、静置。主要发生的化学反应的方程式有________________________________、__________________________________。
②(3分)过滤步骤①所得的物质,得到的滤液中一定含有的溶质是___________、NaOH(填化学式);可能含有的溶质是Ca(OH)2或Na2CO3。上述两种可能含有的溶质能否同时存在呢?________。(填“能”或“否”)理由是_____________________________________________。
③(4分)小明为了探究步骤②所得的滤液中可能含有的溶质是否存在,请你帮他完成实验设计。
A.取少量滤液,_____________________________________________________,若出现白色沉淀,说明滤液中含有Ca(OH)2,反之,滤液中不含Ca(OH)2。
B.取少量滤液,____________________________________________________,则说明存在Na2CO3。反之,滤液中不含Na2CO3。
④经过上述鉴定,滤液中一定有Na2CO3,如果小明还想继续鉴定滤液中NaOH的存在,则它采用的鉴定方法是____________________________________________________________。(提示:碳酸铜(CuCO3)是蓝色沉淀)
五、(7分)以单质、氧化物、酸、碱、盐等物质之间的知识联系为主的专题探究
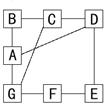 16.有A、B、C、D、E、F、G七种物质,它们可能是Fe、H2SO4、NaOH、H2、O2、Fe2O3、HCl。下图中凡用直线相连的两种物质间均可发生化学反应(部分反应的条件略去)
16.有A、B、C、D、E、F、G七种物质,它们可能是Fe、H2SO4、NaOH、H2、O2、Fe2O3、HCl。下图中凡用直线相连的两种物质间均可发生化学反应(部分反应的条件略去)
试推断A、B、C、D、E、F、G分别是什么物质?
A_________;B__________;C__________;D__________;E___________;
F_________;G__________。
六、(12分)对氢氧化钠固体变质的有关探究
17.甲同学为了探究一包放置很久的氢氧化钠固体是否变质,他用到了试剂X溶液,乙同学为了除去氢氧化钠固体变质后所含的杂质,他也用到了试剂X溶液,则该试剂X可能是___________或____________。(填化学式) 丙同学为了探究实验室中久置的NaOH的变质程度,他设计了如下的研究性学习课题报告,请你帮助加以完善。
[研究方案]先称取13.3gNaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。从而进一步确定样品中NaOH的变质程度。
[解决问题]实验测得加入稀盐酸的质量与产生CO2气体的质量关系如右下图所示。
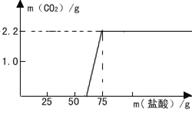 填写下表:(计算结果保留小数点后面一位)
填写下表:(计算结果保留小数点后面一位)
| Na2CO3的质量 | |
| 变质NaOH的质量 | |
| NaOH的变质程度 (用质量分数表示) |
[继续探究]计算实验过程中与NaOH反应消耗盐酸的质量。
[发现问题]根据“与NaOH反应消耗盐酸的质量”,对照图像,你发现了什么问题?
________________________________________________________________________________