中考二模考试化学试题
(满分60分)
可能用到的相对原子质量:
Ca:40 Na:23 H:1 C:12 N:14 O:16 Cl:35.5
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)
1、下列变化中,属于物理变化的是 ( )
A、馒头发霉 B、用高粱酿酒 C、汽油挥发 D、酒精燃烧
2、下列实验现象描述错误的是 ( )
A、铁丝在氧气中燃烧,火星四射,生成黑色的固体
B、硫在氧气中燃烧,生成二氧化硫
C、铁钉置于稀硫酸中,表面有大量气泡产生,溶液由无色变为浅绿色
D、镁在空气中燃烧发出耀眼强光
3、日常生活中的很多问题需要化学知识,下列认识不正确的是 ( )
A、研制生产可降解塑料的主要目的是解决“白色污染”问题
B、我国规定食盐中必须加碘,这里的“碘”是指碘元素
C、煤燃烧过程中产生的二氧化硫是引起温室效应的主要物质
D、通常所说的煤气中毒是指CO引起的中毒
4、化学是一门以实验为基础的自然科学,通过实验可以得知物质的组成、结构、性质及
变化规律。下列通过实验得出的结论正确的是 ( )
A.通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构
B.水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成
C.能在氧气中燃烧,说明氧气具有可燃性
D.将紫色石蕊试液分别滴入稀盐酸、稀硫酸中,溶液均显红色,说明紫色石蕊试液一般能使酸变红。
5、某元素R的氧化物溶于水后,所得溶液的pH大于7,则元素R的原子结构示意图可能是 ( )
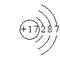 | 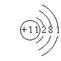 | ||||
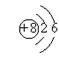 | |||||
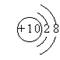 A.
B.
C.
D.
A.
B.
C.
D.
6、现有烧碱、铁片、氢氧化铜、盐酸、大理石五种物质,从缺乏反应物的角度分析,下列
实验项目中无法进行的是 ( )
A.制取氢气 B.制取铜 C.制取氢氧化铁 D.制取碳酸钠
7、 某气体M中可能含有H2、CO、CO2和水蒸气中的一种或几种。把M通过灼热的盛有足量氧化铜的试管,充分反应后,管内物质质量减少0.8g。将反应后的气体通过盛有足量浓硫酸的洗气瓶,洗气瓶中物质增重0.8g。气体M的组成不可能是 ( )
A、H2、CO 、 水蒸气 B、H2、CO2 、CO
C、H2、、CO2 、水蒸气 D、H2、、CO2 、CO、水蒸气
8、下列四个图象表示四种对应的操作过程,其中正确的是 ( )
A、向PH=10的NaOH溶液中不断加水
B、把相同质量的铝和镁放入足量的等质量等浓度的盐酸中
C、把铁棒放入硫酸铜溶液中
 D、一定温度下向10%的硝酸钾溶液中不断加入硝酸钾晶体
D、一定温度下向10%的硝酸钾溶液中不断加入硝酸钾晶体
9、给病人注射用的生理盐水的质量分数是0.9%,则其中水和氯化钠的质量比是( )
A、991:1 B、991:9 C、99:1 D、99:9
10、在CO和CO2 的混合气体中,氧元素的质量百分数为64%,将10克混合气体通入足量的澄清石灰水中,得到白色沉淀 ( )
A、 2.8 g B、 10 g C、 5 g D、 4.4 g
二、填空题(本题共7小题,共35分)
11、(4分)根据对物质的存在或性质或用途的描述,写出该物质的化学式及物质的类别(单质、氧化物、酸、碱、盐、有机物)
| 物质的存在、性质、用途 | 化学式 | 物质类别 |
| 在自然界中以气、液、固三态存在,地球表面约70%被它覆盖 | ||
| 地壳中含量最多的金属元素 | ||
| 人体胃液中呈酸性的物质 | ||
| 在农业生产中,常用于改良土壤酸性的物质 |
12、(3分)现有H2 、CO、CO2 三种气体,请从不同的角度指出其中任一气体与另外两种气体的不同之处。例如:CO2 无可燃性。
① ;② ;③ 。
13、(2分)我们已经学过碱性氧化物和酸性氧化物,到高中还要学习一类两性氧化物,如Al2O3 。当Al2O3 与酸、碱反应如下:
Al2O3 + 6HCl === 2AlCl3 + 3H2O Al2O3 + 2NaOH === 2NaAlO2 + H2O
你能否概括出两性氧化物的定义_____________________________________ 。
14、(8分)年来出现的厄尔尼诺现象与大气中CO2含量的增多有关,请回答以下问题:
(1)空气中二氧化碳主要来源是 ________________;
(2)自然界中能消耗二氧化碳的是________ 作用,该反应用文字表述为:______________________________________________;
(3)为减缓此现象,你认为最理想的燃料是______;以水为原料,开发此燃料,你认为应研究的主要课题是_______________________。
(4) 汽车尾气(含有CO、SO2与NO等物质)是城市空气污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO和NO反应,生成可参与大气生态环境循环的无毒气体,写出CO和NO反应的化学方程式________________________ ;
控制城市汽车尾气对空气造成污染的方法是________ (填写序号):
①开发新能源; ②使用电动车; ③植树造林; ④戴呼吸面具。
15、(7分)有四家化工厂排放的废水中溶质的主要成分如下表:
| 厂名 | A厂 | B厂 | C厂 | D厂 |
| 废水中溶质的主要成分 | H2SO4 | K2CO3 | Ca(OH)2 | CuCl2 |
为保护环境、防止污染,四厂决定联合处理废水,其处理方案如下:
 |
(1)排气池中发生反应的化学方程式为:_________________________________________;
(2)沉淀池中出现的现象是________________,由此产生的废弃物是________________;
(3)若排气池中B厂废水过量,沉淀池中D厂废水过量,则混合时发生反应的化学方程式为:__________________________________________;
(4)若排气池中A厂废水过量,且沉淀池中______厂废水过量,会导致达标检测不合格。
16、(3分)在化学研究课上,为了验证氨气(NH3)的某些性质,小李同学做了以下实验:下图中从左向右依次是他做的实验及相应现象。
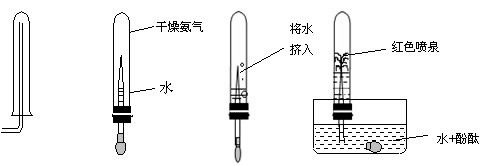 |
通过以上实验,小李得出了关于氨气的三点性质,你认为它们是:
__________________________________________________________________;
17、(8分)实验室里除了用氢气还原氧化铜之外还可以用氨气来还原氧化铜。某课外兴趣小组的同学欲设计一实验,在实验室制取氨气,用氨气来还原氧化铜,并通过测量相关物质的质量计算铜的近似相对原子质量。一同学查阅资料得知实验室可以用加热熟石灰与氯化铵固体的方法获得氨气,并且如将纯净的氨气通过红热的氧化铜,可得到氮气,同时生成铜和水。反应方程式如下: 2NH3+3CuO ![]() N2+3Cu +3H2O
;另一同学查阅资料得知碱石灰成分为氢氧化钠与生石灰的固体混合物,他也发现氨气极易溶于水,生成的氨水是一种弱碱,并且氨气还可以与酸直接化合生成铵盐,如:NH3 +HCl === NH4Cl
N2+3Cu +3H2O
;另一同学查阅资料得知碱石灰成分为氢氧化钠与生石灰的固体混合物,他也发现氨气极易溶于水,生成的氨水是一种弱碱,并且氨气还可以与酸直接化合生成铵盐,如:NH3 +HCl === NH4Cl
![]()
A B
A B C D
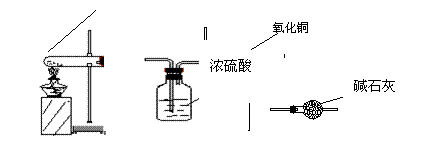
试回答:如果选用测定反应物CuO 和生成物H2O 的质量[m(CuO)、m(H2O)]
① 仪器连接的顺序(用字母编号表示,仪器可重复使用)_______________________ ;
② 写出生成氨气的化学方程式_______________________ ;
③ 实验完毕时观察到A中的主要现象是_______________________ ;
④ 列出计算Cu的相对原子质量的表达式(已知除铜以外各原子的相对原子质量)_______________________ ;如果实验中CuO 未完全还原成Cu 则测得的结果与CuO 完全还原成Cu 所得结果相比会________ (选填偏大、偏小、相同)。
⑤ 有位同学认为可利用上述装置可获得纯净的氮气,你认为仪器连接的顺序应有什么改动,新的顺序为(要求同第①小题)_______________________ 。
三、本题共5分
18、把氯化钠和氯化钙混合物的粉末20克,放到盛有96克水的烧杯中完全溶解后,再向其中加入100克浓度为10.6%的碳酸钠溶液,恰好完全反应。试求:
(1)原混合物中氯化钠的质量分数;(2分)
(2)反应后所得溶液的质量分数。(3分)
参考答案
一、(每空2分 共20分)
1、C 2、B 3、C 4、A 5、D 6、C 7、C 8、B 9、B 10、B
二、11、(每空0.5分 共4分)H2O 氧化物 ;Al 单质 ;HCl 酸 ; Ca(OH)2 碱
12、(每空1分 共3分,答案合理就给分)CO有毒;H2 能充气球;CO2 能灭火
13、(2分)既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫两性
氧化物。
14、(每空1分 ,化学方程式2分 ,共8分)(1)含碳燃料的燃烧;(2)光合作用
|
![]()
|
|
(4)2CO+2NO======= N2+2CO2 ①②③
15、(每空1分 ,化学方程式2分 ,共6分)
(1)、H2SO4 + K2CO3 == K2SO4 + H2O + CO2↑ (2)蓝色沉淀 Cu(OH)2
(3)K2CO3 + CuCl2 == CuCO3↓+ 2KCl (4)D
16、(每个1分,共3分)NH3 密度比空气小; NH3易溶于水 ;NH3显碱性;
17、(①、③、⑤每空1分 ,②④每空2分 ,共8分)
①A、D、B、D ② 2NH4Cl
+ Ca(OH)2
![]() CaCl2 +2NH3↑+2H2O
CaCl2 +2NH3↑+2H2O
|
![]()
|
18、(1)(2分) 设有氯化钙的质量为X
CaCl2 + Na2CO3 === CaCO3↓ +2NaCl
111/X =106/100g×10.6% X=11.1g NaCl % =(20g-11.1g)/20g = 44.5%
(2)(3 分)CaCl2 + Na2CO3 === CaCO3↓ +2 NaCl
设生成氯化钙的质量为Y, 106/10.6g=117/Y , Y=11.7g
设生成碳酸钙的质量为W ,106/10.6g=100/W W=10.0g
溶液总质量为: 20g+96g+100g-10g=206 g NaCl 总质量为:8.9g+11.7g=20.6g
NaCl %=20.6g/206g=10%
(命题:王 玮)