中考化学计算题专题训练
一、选择题中的计算
1.某化合物化学式为R(H2PO4)2,当P元素显+5价时,元素R在该化合物中化合价为( )
A.+1价 B.+2价 C.+3价 D.+4价
2.在硫化钾中,钾元素和硫元素的质量比为( )
A.39:32 B.39:16 C.39:64 D.39:48
3.t℃时,m克某饱和溶液的溶质的质量分数为a%,则该物质在该温度下的溶解度为( )
A.m a / (m+a) 克 B.ma/(100-a)克
C.100a/(100+a ) 克 D.100a/(100-a)克
4.由氮和氧两种元素组成的化合物中,氮元素和氧元素的质量比是 7:4,则此化合物中氮元素的化合价为( )
A.+1 B.+2 C.+4 D.+5
5.将4.9克氯酸钾与1.62克二氧化锰混合后,放入试管中加热,充分反应后剩余固体的质量为( )
A.1.62克 B.2.98克 C.4.60克 D.6.52克
6.CO2和CO的混合气体a克,通入足量的澄清石灰水中,最多能生成b克沉淀,则原混合气体中CO的质量分数为( )
A.0.44b/a B.(a-0.44b)/a C.(a-0.22b)/a-b D.(a-0.22b)/b
7.在天平两边的托盘上各放一个盛有36.5克质量分数为20%的盐酸的烧杯,此时天平是平衡的。现将一定量的两种物质分别放入烧杯中,两烧杯中反应恰好完全,此时天平仍保持平衡,则加入的物质可能是( )
A.Mg和MgO B.MgO和Mg(OH)2
C.Mg和MgCO3 D.MgO和MgCO3
8.经测定某溶液中有Cu2+,K+,SO42-,Cl-四种离子,其中K+离子与Cu2+离子的个数比是4:3,那么SO42-离子与Cl-离子的个数比可能为( )
A.3:2 B.1:3 C.2:5 D.1:8
9.把10克氯化钠放入40克水中,完全溶解后,溶液中氯化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
10.某二价金属的氧化物中金属元素和氧元素的质量比3:2, 则该金属的相对原子质量为
(A)40 (B)56 (C)27 (D)
11.X、Y、Z、Q四种元素的核电荷数分别为a、b、c、d,若它们的离子Xm+、Yn+、Zm-、Qn-的电子层数相同,则下列关系正确的是( )
A.a-b=n-m B.b-d=2n C.c-d=m+n D.a-c=0
12.在密闭容器中,7.2克碳与一定量氧气恰好完全反应,生成的气体的质量可能是( )
A.8.4克 B.17.8克 C.26.4克 D.44.0克
13.X、Y两种元素间能形成多种化合物,已知其中一种化合物XY中,X 元素的质量分数为46.7%,则下列化合物中X的质量分数大于46.7%的是( )
A.XY2 B.X2Y3 C.X2Y D.X2Y5
14.在一烧杯中盛有10%的某硫酸溶液中,加入BaCl2溶液直至不再产生沉淀为止,生成沉淀的质量等于原硫酸溶液质量的1/2,则原硫酸溶液中溶质质量分数为[ ]
A.21.0% B.23.8% C.42.1% D.84.1%
15.相同质量的镁、锌、铁三种金属分别与足量的稀盐酸反应,生成氢气的质量( )
(A)Mg>Fe>Zn (B)Zn < Mg > Fe
(C)Fe>Zn>Mg (D)Zn = Mg = Zn
16.托盘天平两端各放置盛有等质量分数的足量的稀硫酸的烧杯,调节天平至平衡,向左边烧杯中加入8g氧化铜,若使天平仍保持平衡,需向右边烧杯中加入的是( )
A. 8.5g锌 B. 8.3g铁 C. 8.6g铝 D. 8g银
二、填空题中的计算
1.CaCl2溶液。然后向烧杯中逐滴滴入10%Na2CO3溶液至不生成沉淀为止。过滤,干燥后,得到沉淀的质量为10克,然后将滤液蒸发掉90 克水,则所剩溶液的溶质的质量分数为 。
2.在反应A+3B=2C+2D中,C和D的相对原子质量比为22:9,已知2.8克A与一定量B完全反应,生成8.8克C,则在此反应中B和C的质量比为 。(填最简整数比)
3.硫酸铵[(NH4)2SO4]中,各元素的质量比是N:H:S:O=___:___:____:____
4.配制100克质量分数为20%的稀硫酸,需要质量分数为98%的浓硫酸____克(结果保留一位小数)。
5.吸毒严重危害人体健康与社会安宁,是世界的一大公害。“摇头丸”是国家严禁的一种毒品,化学式为![]() ,它由_____种元素组成,其相对分子质量为_________。
,它由_____种元素组成,其相对分子质量为_________。
6.氨是生产氮肥的原料,氨水也可直接做氮肥使用。氨(![]() )中,氮元素的化合价为___________。
)中,氮元素的化合价为___________。
7.市售脑黄金(DHA)的化学式为![]() ,试计算:]
,试计算:]
(1)脑黄金的相对分子质量为______________。
(2)计算脑黄金中碳元素质量分数的表达式是_____________。
8. 100g稀盐酸恰好与80g 10%的氢氧化钠溶液完全反应。求:
(1)生成![]() 的质量是多少克?
的质量是多少克?
(2)稀盐酸的溶质质量分数是多少?
9.为了测定某种硫酸铜晶体(![]() )中的X值,做下列实验。
)中的X值,做下列实验。
将含结晶水的硫酸铜放在坩埚中加热,直到不含结晶水为止(![]() ),冷却至室温,称量测得的数据为:
),冷却至室温,称量测得的数据为:
| 质量/g | |
| 坩埚+硫酸铜晶体 | 21.26 |
| 坩埚+无水硫酸铜 | 20.72 |
| 坩埚 | 19.13 |
根据实验数据,经计算得X=___________。
10.某物质的化学式为AxBy,A、B的相对原子质量(原子量)分别是m、n,则B元素的质量分数是__________。
三、要求写过程的计算题
例:1、将足量镁粉投入到200克12.25%的稀硫酸中,完全反应后,滤出剩余的镁粉,得到滤液.试计算:(1)生成硫酸镁的质量为多少克?
(2)滤液的溶质质量分数为多少?
(3)在一定温度下,硫酸镁的溶解度为40克.若要将上述滤液变为该温度下的饱和溶液,需加入硫酸镁多少克?
解:(1)设生成硫酸镁的质量为x
Mg + H2SO4 = MgSO4 + H2↑
98 120
200g×12.25% x
98:120 = 200g×12.25%:x x = 30g
(2) 设反应的镁的质量为y,生成氢气的质量为z
Mg + H2SO4 = MgSO4 + H2↑
24 98 2
y 200g×12.25% z
24:98 = y:200g×12.25% y = 6g
2:98 = z:200g×12.25% z =0.5g
滤液的质量为:6g +200g-0.5g=205.5g
![]() 滤液的溶质质量分数为:
滤液的溶质质量分数为:
(3) 设加入硫酸镁的质量为m
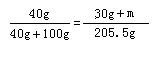
m=28.6g
答:生成硫酸镁的质量为30g;滤液的溶质质量分数为14.6%;需加入硫酸镁28.6g。
2、在氯化钡和氯化钠组成的混合物中,取其28克置于50克水中充分溶解后,加入71克某溶质质量分数的硫酸钠恰好完全反应,生成沉淀23.3克。计算:
(1)原混合物中氯化钠的质量。
(2)滤去沉淀,某温度下在所得滤液中加入19.6克氯化钠固体,刚好为饱和溶液,计算该温度下溶质的溶解度。(了解)
3、25克含碳酸钙80%的大理石恰好与100克某盐酸溶液完全反应(杂质不与盐酸反应,且不溶解)。求:(1)生成二氧化碳的质量;
(2)原盐酸溶液的溶质质量分数;
(3)的反应后溶液的质量。
4、某工厂化验室需要配制 5000 克质量分数为 20% 的盐酸,问需质量百分数为 38% 的盐酸(密度是 1.19克/厘米![]() )多少毫升?
)多少毫升?
5、一定质量的20%的烧碱溶液与一定质量的硫酸镁溶液恰好完全反应。所得溶液的质量为142克,其中溶质的质量分数为15%。计算硫酸镁溶液中溶质的质量分数。(计算结果精确到0.1%)
6、氧化钙和碳酸钙的混合物粉末66克,恰好与400克盐酸完全反应,生成二氧化碳气体4.4克.求原混合物中氧化钙和碳酸钙各自的质量和该盐酸的质量分数。.
7、已知Na2SO4 样品中混有少量 NaCl 杂质.今取该样品 7.5 克溶于水,然后逐滴加入BaCl2 溶液到不再产生沉淀为止,经过滤、干燥后,得到沉淀物 11.65 克,求该样品中Na2SO4 的质量分数是多少?
8、加热一黑色粉末固体,并将所得气体通入50克烧碱溶液中发现溶液变成了54.4克,再用7.3克10%的盐酸滴加剩余黑色粉末固体,黑色粉末固体全部溶解。
(1) 判断黑色粉末固体的组成。
(2) 黑色粉末固体中各物质的质量分数。
在实验室中制取8.8克二氧化碳,需要多少含杂质20%的石灰石跟适量的盐酸反应(杂质不与盐酸反应)?
9、某兴趣小组用2.5 g一氧化碳做还原氧化铜实验,将收集到的所有尾气通入50.8 g的氢氧化钠溶液中,恰好完全反应得到53 g碳酸钠溶液。试计算(1)Na2CO3的式量。 (2)所得碳酸钠溶液中溶质的质量分数。 (3)2.5 g一氧化碳中参加反应的一氧化碳的质量分数。
10、计算10吨含氧化铁80%的赤铁矿石,可以炼出含杂质4%的生铁多少吨?
11、将KMnO4和KClO3的混合物56.1克,加热使其充分反应后,剩余的残渣中有MnO28.7克.计算:①原混合物中含有KMnO4和KClO3各多少克?②生成氧气多少升?(标准下氧气的密度为1.429克/升)
12、将氯化钠与硝酸钠的混合物6.5克,溶于17克水中。充分溶解后,加入68克硝酸银溶液,恰好完全反应,生成14.35克沉淀。过滤,向滤液中再加入50.7克硝酸钠,恰好溶解得到20℃的饱和溶液。求:
(1) 原混合物中氯化钠的质量分数
(2) 滤出沉淀后所得溶液中硝酸钠的质量分数
(3) 20℃时硝酸钠的溶解度。 (了解)
13、甲、乙、丙、丁四位同学,用锌与稀硫酸反应,所得相关数据记录如下,(实验中的误差忽略不计)
| 甲 | 乙 | 丙 | 丁 | |
| 取用稀硫酸质量(克) | 100 | 100 | 100 | 200 |
| 加入金属的质量(克) | x | 1.25x | 2x | 2x |
| 生成H2的质量(克) | 0.4 | 0.5 | 0.6 | 0.8 |
求:⑴ 甲同学加入金属锌的质量x。
⑵ 稀硫酸中溶质的质量分数。