初三化学复习模拟练习
班级 姓名 学号 成绩
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Fe 56
一、选择题(每题只有一个选项符合题意。每小题2分,本题共34分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | / |
| 答案 | / |
1. 化学家在当今环境问题上的最新构想是“变废为宝,资源循环”。例如,①燃料(CH4、CH3OH等)→燃烧产物(CO2、H2等);②燃烧产物(CO2、H2O等) →燃料(CH4、CH3OH等)。这样既可解决能源问题,又能消除污染。上述构想①、②两个转化过程所属变化为
A、均为物理变化 B、①为物理变化,②为化学变化
C、均为化学变化 D、①为化学变化,②为物理变化
2.一些国家试用碳酸水浇灌某些植物,这样做的目的是①改良碱性土壤 ②改良酸性土壤 ③有利于植物的光合作用 ④提高农作物的产量
A.①②③④ B.①③④ C. ②③④ D.①②④
3. 下列有关物质性质和用途关系的叙述,错误的是( )
A.由于氢气燃烧,能出大量的热,所以可用作燃料
B.烧碱极易吸收水分,可用来干燥二氧化碳气体
C.金刚石的硬度很大,常用作切割玻璃,大理石等
D.由于铝具有良好的导电性,因此常用作制造电缆电线等
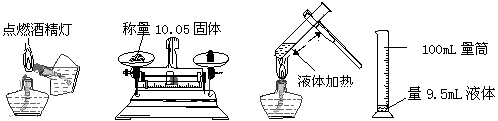 4. 下列实验操作正确的是
4. 下列实验操作正确的是
A B C D
5. 宣传科学、弘扬科学精神是我们中学生应尽的义务。你认为下列说法或传闻中的有科学依据的是 A、一商贩在大街上出售可溶解任何物质的溶剂
B、欧洲某地有一神秘的溶洞,游人带的宠物走进洞底时会窒息而死
C、某研究机构研发了一种催化剂,只需添加少量,就能将水变成汽油
D、苯甲酸钠是一种防腐剂,为防止食物腐败,可在食品中加入不限量的苯甲酸钠
6.日常生活中,人们常喝纯净水。市场上销售的纯净水有一些是蒸馏水。对于这一类纯净水的说法,正确的是
A.它的pH=1 B.它含人体所需的多种矿物质
C.它能溶解所有的物质 D.它清洁、纯净,但长期饮用对健康不利
7. 下列关于分子和原子的说法中不正确的是
A.原子是不能再分的最小粒子 B.分子和原子都是构成物质的粒子
C.分子和原子都在不停地运动 D.水分子是保持水的化学性质的最小粒子
8. 某同学想用实验证明硫酸铜溶液显蓝色与SO42-无关,只进行下列实验无意义的是
A、 观察硫酸钠溶液没有颜色
B、 向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C、 向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D、加水稀释硫酸铜溶液,溶液蓝色变浅
9.已知硝酸铷化学式为RbNO3 ,则其相同价态下的氧化物的化学式为
A. RbO B.Rb2O C.RbO2 D.RbO3
10.经实验测定,某物质中只含有一种元素,下列推断正确的是
A.该物质一定是纯净物 B. 该物质一定是单质
C.该物质一定是混合物 D.该物质一定不是化合物
![]() 11.用I2O5可以测定空气受CO污染的程度,发生反应的化学方程式如下:
11.用I2O5可以测定空气受CO污染的程度,发生反应的化学方程式如下:
I2O5 +5CO I2 +5CO2 ,根据生成CO2的多少,可以判断CO含量。对这个反应,下列说法正确的是
A.参加反应的I2O5质量等于生成的I2的质量
B.相同条件下生成的CO2气体越多,说明空气受CO污染的程度越小
C.参加反应的I2O5和CO的质量比,等于生成的I2和CO2的质量比
D.CO2中的氧原子总数等于I2O5和CO中氧原子总数
12. 天文学家在研究星系运动方式时发现人们所观测到的星系其内部的引力仅占“物质”引力总量的1%~10%,其他是大量的非星系内部引力,这一现象表明,有些“物质”是不可见的,原因是它们不发光也不反射光,因此,科学家称这些可能存在的“物质”为“暗物质”,然而,直到现在人类仍没有探索到“暗物质”存在的任何证据,对此,你认为下列4种观点中可取的是 ①“暗物质”是人类虚构出来的,事实上,宇宙中根本就不存在
②“暗物质”可能存在,人类后不断地进行探索,一旦发现它存在的证据,将为人类重新认识宇宙开辟一个全新的视角
③“暗物质”可能会存在距地球十分遥远的地方,科学家可以通过探索“暗物质”产生的粒子的存在而间接证明“暗物质”的存在
④人类探索至今,仍未发现“暗物质”,说明“暗物质”是不存在的
A. ①④ B. ②③ C. ①②④ D. ①③④
![]()
![]()
![]()
![]() 13. 符合下列转化关系的物质甲是
13. 符合下列转化关系的物质甲是
甲 乙 丙 丁 甲
A.Cu B.CuO C.Fe2O3 D.MgO
14.向盛有铁、氢氧化铁、氢氧化铜和氢氧化钡的固体混合物的烧杯中,加入一定量的稀硫酸,充分反应后过滤,滤液显碱性,滤纸上留有的物质是
A.只有BaSO4 B.只有BaSO4 和Fe
C.有Fe、Fe(OH)3、Cu(OH)2、Ba(OH)2 D.有Fe、Fe(OH)3、Cu(OH)2、BaSO4
15.实验中如果发生下列事故,处理方法不正确的是( )
A.浓硫酸溅到皮肤上先迅速用布拭去,再用水冲洗,然后涂上稀的碳酸氢钠溶液
B.浓氢氧化钠溶液沾到皮肤上,先用较多水冲洗再涂上硼酸溶液
C.酒精漏洒在桌面上并遇火发生燃烧,迅速用沙袋或湿布盖灭
D.地面上汇漏的汽油遇火燃烧,赶紧浇水灭火
16.Fe、Mg、Al三种金属分别跟稀盐酸充分反应,得到相同质量的氢气,其原因有①Fe、Mg、Al的质量相等 ②Fe、Mg、Al的质量比为56:24:27 ③Fe、Mg、Al的质量比为28:12:9 ④Fe、Mg、Al均为过量,所用的盐酸的质量和溶质质量分数都相同。你认为可能的原因是A.③④ B.①② C.①③ D.②③
17.有一空气中暴露过的NaOH固体,分析测知含水6.62% Na2CO3 2.38% NaOH 91% ,将此样品1g加到46g质量分数为3.65%的盐酸中,过量的盐酸用质量分数为4.43%的NaOH溶液中和,用去20.59g,蒸干中和后的溶液,可得到固体的质量为( )
A.1.33g B.2.69g C.3.43g D.无法确定
二、选择题(每题有一个或两个选项符合题意,本题共10分。)
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
18. 若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则下列说法正确的是
A.溶液的质量一定变小 B.溶液中溶剂的质量一定变小
C.硝酸钾的溶解度可能变大 D.溶液中溶质的质量分数可能不变
19.下列各组溶液中,不用其它任何试剂就能鉴别出来的是
A. KCl、AgNO3、HCl、HNO3 B.BaCl2、Na2SO4、Na2CO3、HCl
C. CuSO4、NaCl、KNO3、BaCl2 D. FeCl3、NaOH、HCl、KCl
20.下列各项应用的主要原理表达正确的是
![]() A.盐酸除铁锈:Fe2O3+4HCl=2FeCl2+2H2O
A.盐酸除铁锈:Fe2O3+4HCl=2FeCl2+2H2O
B.天然气做气体燃料:CH4+O2 CO2+2H2O
![]() C.除去氧化铜中少量碱式碳酸铜:Cu2(OH)2CO3 2CuO+CO2
↑ +H2O
C.除去氧化铜中少量碱式碳酸铜:Cu2(OH)2CO3 2CuO+CO2
↑ +H2O
D.服用Al(OH)3治疗胃酸过多:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
21. 配制100 g 10%的盐酸,需要20%的盐酸(密度是1.1 g /cm3)的体积与水的质量分别是
A.50 gmL 50 g B.55mL 40.5 g C.45.5 mL 50 g D.45.5 mL 54.5 g
22. 对下列实验过程的评价,正确的是
A.某无色溶液中滴入酚酞试液变红色,该溶液不一定是碱溶液
B.某溶液滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中不一定含有SO42―
C.检验氢气纯度时,将一收集气体的试管移近火焰,没有响声,表明氢气纯净
D.验证烧碱溶液中是否含有Cl― ,先加稀盐酸除去OH― ,再加AgNO3溶液有白色沉淀出现证明含Cl―
三、填空题 (共28分)
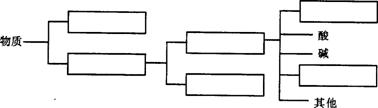
23.(共3分)下面是物质分类图,请将“氧化物”、“化合物”、“单质”、“纯净物”、“混合物”、“盐”等名词分别填入适当的方框中:
24.某些物质在不同反应条件下可以相互转化。试仿照下例,用化学方程式填写下表。
| 示例 | Na2CO3 +CO2 +H2O =2NaHCO3 |
|
| (1) | ||
| (2) |
25.(1)在通常情况下,碳单质的化学性质稳定,但它在常温下可与一种叫高氯酸的物质发生反应,工业上利用石墨合成金刚石,要得到纯净的金刚石,用高氯酸(HClO4)来洗掉夹杂的石墨,产物除水是液体外,其余都是气体。一种是有毒的氯气(Cl2)一种是无色无毒的化合物,请写出此反应的化学方程式:
(2)淀粉[C6Hl0O5]n在人体酶的作用下转变成葡萄糖(C6H12O6),葡萄糖又在酶的作用下经缓慢氧化转变成二氧化碳和水,同时放出能量,供机体活动和维持恒定体温的需要。葡萄糖由 种元素组成,在一个葡萄糖分子中含有 个原子,它的相对分子质量是 。写出葡萄糖缓慢氧化的化学方程式 。
(3)人类大量开采煤和石油,将使化石燃料面临枯竭。对于能源危机,我们应采取的措施是 。如果你是央视小记者,为了警示人们,请你拟一条公益广告语: 。
26.右图为A、B两种固体物质的溶解度曲线。试根据图中所给信息回答下列问题:
![]()
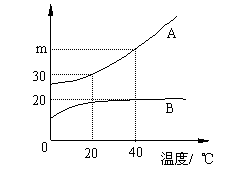 (1)20℃时,在50 g水中加入30 g物质A,
得到A溶液的溶质质量分数为__________。
(1)20℃时,在50 g水中加入30 g物质A,
得到A溶液的溶质质量分数为__________。
(2)40℃时,60 g A的饱和溶液与60 g B的 饱和溶液中,A与B的质量比为2∶1,则m=________。
(3)在同一温度下,A和B能否配制成质量分数相同的饱和溶液?答(“能”或“否”)_____,其理由是__________________________________。
27.2005年3月15日,京沪高速公路江苏段发生氯气(Cl2)泄漏事故,造成人员重大伤亡,周围十五万群众紧急撤离。氯气是一种黄绿色、有毒、有剧烈刺激性气味的气体,同温同压下同体积的氯气密度比空气大,能溶于水,并与水反应生成盐酸(HCl)和次氯酸(HClO)。
(1)根据以上信息,氯气的物理性质有
(2)据报道:氯气罐内为液氯(Cl2),因氯气罐泄漏处置不当使液氯急剧挥发产生爆炸,造成氯气罐爆炸的直接原因属于 变化。
(3)消防队员用高压水枪喷水溶解弥漫在空气中的氯气。写出氯气与水反应的化学方程式 。
(4)抢险中将液氯抽出排放到含Ca(OH)2的水池中,使氯气不再对四周居民造成危害。写出氯气与Ca(OH)2反应的化学方程式为 。
(5)我可为现场居民提出的自救建议是 。
28.下列四种物质在水、液氨中各自的溶解度(克/100克溶剂)如下表所示:
| 物质 | 水 | 液氨 |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | ~0 |
在水或液氨中,这四种化合物中的某两种可能发生复分解反应,其化学方程式分别为:在水中
在液氨中
29.把m克物质溶于水配成100克溶质的质量分数为n%的溶液。已知A可能是Na2O、SO3、NaCl、KNO3、Na2CO3·10H2O、CuSO4·5H2O中的一种或两种。请依据下列要求填空: (1)当m = n时,A物质是 。
(2)当m>n时,A物质是 。
(3)当m<n时,A物质是 。
四、 推断题(每空1分,共12分)
30.有一无色混合气体A,可能是由CO、CO2、H2、N2、H2O(水蒸气)中的一种或几种组成。为确定其组成,某学生按下列方案进行试验(假设每步反应均完全),
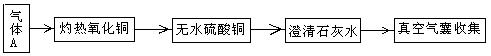
请回答下列问题:
⑴若灼热的氧化铜变红色,则气体A中可能含有 ;
⑵若澄清石灰水变浑浊,则气体A中可能含有 ;
⑶上述方案应如何改进,才能确证混合气体A的组成?(可用流程图表示)
。
![]()
![]()
![]()
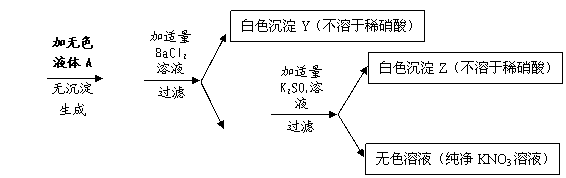 31.以下是几种物质间相互转化关系示意图。其中无色液体A是纯净物或只含一种溶质的溶液(X与A中溶质不是同一种物质,且设每一步反应都恰好完全进行)。
31.以下是几种物质间相互转化关系示意图。其中无色液体A是纯净物或只含一种溶质的溶液(X与A中溶质不是同一种物质,且设每一步反应都恰好完全进行)。
(1)用化学式回答:Y是 ;Z是 ;
(2)晶体X 和无色液体A可能分别是(用化学式填写下列表格,不必填满,要求答全,若是溶液只写溶质的化学式):(每组答案正确给1分)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| X | ||||||
| A |
(3)若将晶体X溶于水,所得溶液中一定含有的离子是(写离子符号,下同) ;可能含有的离子是 。
 五、实验题(每空1分,共10分)
五、实验题(每空1分,共10分)
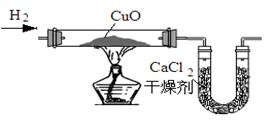
32.课本习题中用氢气还原灼热氧化铜测定水的组成的实验装置如右图。
(1) 实验室通常用来制取氢气的药品是 ___________________。
(2) 用该装置测定水的组成的结果与理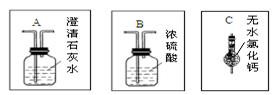 论值存在较大偏差,可在该装置中增添部分装置,减小这种偏差。你认为需要添加的部分装置是右图中的_________ (填“A”或“B”或“C”),对应连接在上述装置_________(填“前”或“后”或“前、后”)。
论值存在较大偏差,可在该装置中增添部分装置,减小这种偏差。你认为需要添加的部分装置是右图中的_________ (填“A”或“B”或“C”),对应连接在上述装置_________(填“前”或“后”或“前、后”)。
(3)该装置中加热氧化铜的部分可进行其它气体和固体的反应,试写出你熟悉的能用该部分装置进行反应的三种不同气体与固体反应得化学方程式(H2除外,三组气体各不相同,反应条件可以加热或高温)
① ;② ;③_____________________。
33.某化学兴趣小组按以下步骤探究某一温度下氯化钠饱和溶液的酸碱度。
猜想或假设:溶液的pH可能为:pH=7
设计和实验:要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的 _(填序号)来进行实验。 ①pH试纸 ②紫色石蕊试液 ③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸湿润,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。
[评价] 三位同学中操作规范的是 _同学。
[结论和分析]
丙同学得出:“凡是盐溶液的pH都等于7”,你认为该结论是否正确? _,
如不正确请举一例说明(如正确,此空不用填)。 。
六、计算题(共6分)
34. “骨质疏松症”是由人体缺钙引起的,可服用补钙剂来治疗。乳酸钙(CaC6H12O6·5H2O)是一种常见的补钙剂,市售乳酸钙片剂每片含乳钙200mg,一个成年人缺钙病人每天服用20片乳酸钙片剂可达到补钙目的。
计算:(计算结果保留整数)
(1)乳酸钙中各元素的质量比。
(2)该成年缺钙病人改用喝牛奶(每100mL牛奶中含钙≥O.104g)来补钙,每天至少需喝多少毫升牛奶。