初三化学(上)期末考试试题
(全卷满分100分,90分钟完卷)
原子量:H—1; N--14;C—12; O—16; Mg-24;Cl—35.5; K—39; Fe—56; Cu—64.
第Ⅰ卷 选择题(共50分)
一.选择题(本大题共40分,每小题只有一个选项符合题意。)
1.生活中常见的下列现象,发生了化学变化的是( )
A.冰雪融化 B.生米煮成熟饭 C.湿衣服晾干 D.玻璃杯炸碎
2.生活中的下列物质,属于纯净物的是( )
A.酱油 B.食醋 C.纯净的糖水 D.水
3.空气中体积百分含量占21%的气体是( )
A,稀有气体 B,氮气 C,氧气 D,二氧化碳
4.某种物质中只含有一种元素,则该物质( )
A.一定是单质 B.一定是混合物 C.一定是纯净物 D.一定不是化合物
5.加热氯酸钾和二氧化锰混合物的过程中,二氧化锰在反应过程中的质量分数是( )
A,保持不变 B,逐渐变大 C,逐渐变小 D,无法确定
6.下列说法正确的是( )
A.分子、原子、离子都是构成物质的粒子 B.单质和化合物的反应一定是置换反应
C. 分子和原子的根本区别在于:分子可以再分而原子不能再分
D. 氧气可用作燃料
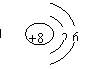 7.下列粒子结构示意图中,表示具有稳定结构的原子的是( )
7.下列粒子结构示意图中,表示具有稳定结构的原子的是( )
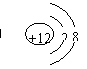 |  | ||||
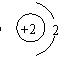 | |||||
A. B. C. D.
8、在下列物质中,锰元素化合价最高的是( )
A,MnO2 B, KMnO4 C, MnCl2 D, K2MnO4
9.若要制得等量的氢气,需要锌、镁、铝、铁的质量最大的是( )
A.锌 B.镁 C.铝 D.铁
10. 下列化学方程式的书写正确的是( )
A.Mg+O2MgO2 B.4P+5O22P2O5
C.2Fe+6HCl===2FeCl3 +3H2↑ D. C+O2====CO2
11.下列实验操作的先后顺序错误的是( )
A.实验室制取气体时,都应先检查装置的气密性,再装入药品
B.实验室用排水法收集氧气结束时,应先将导管移出水面,再熄灭酒精灯
C.点燃任何可燃性气体前,都必须首先检查其纯度
D. 检查装置的气密性时,应先用两手紧贴容器外壁,再把导管的一端放在水里
12.实验室用氢气还原氧化铜制取6.4克铜,实际需要氢气的量是( )
A.等于0.2克 B. 大于0.2克 C. 小于0.2克 D.无法确定
13.元素的化学性质、元素的化合价、元素的分类都是由原子的( )决定的。
A.核电荷数 B.核外电子数 C.质子数 D.最外层电子数
14、根据元素化合价,判断下列化学式正确的是( )
A.氧化钠NaO;B、氯化铁FeCl2;C、硫酸钙Ca2SO4;D、硫酸铵(NH4) 2SO4。
15、下列物质中存在氧分子的是( )
A.纯水; B、液氧; C、二氧化碳; D、氯酸钾
16、相同的SO2和CO2分子中,含有相同的( )
A,氧分子个数 B,氧原子个数
C,氧元素个数 D,碳元素与硫元素的质量
17、下列关于水的说法正确的是( )
A,水分子是两个氢元素和1个氧元素构成的
B,水是由氢元素和氧元素组成的
C,水分子是由一个氢分子和一个氧原子构成的
D,水是由氢原子和氧原子构成的
18、下列物质中,含碳的质量分数最大的是( )
A,CO B,CH4 C,C2H2 D,CO2
19.洁白的沙滩,清新的空气,蔚蓝的天空,这是我们的家园,要保护好我们美丽的家园,就要控制污染物的排放。下列气体中允许向空气中大量排放的是( )
A.二氧化氮 B.氮气 C.一氧化碳 D.二氧化硫
20、某+3价的金属元素M,在与氧形成的化合物中百分含量为70%,则M的相对原子质量为( )
A、112 B、27 C、56 D、11
第Ⅰ卷 选择题答题栏(共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷 非选择题(共60分)
一、填空题(本大题共29分)
21.用化学用语表示:
⑴空气中含量最多的物质是 ;⑵人体内含量最多的元素是 ;
⑶三个水分子 ; ⑷五个亚铁离子 。
22. 细铁丝在氧气中燃烧的化学方程式是____________,参加这一反应的最小粒子是__________________。做该实验时,我们预先在集气瓶里__________________,其目的是_______________。
23.俗话说,酒香不怕巷子深。这句话体现了分子的哪一点性质? ;
50ml酒精和50ml水混合后总体积小于100ml,则说明分子 。
24.某元素X的- 2价阴离子结构示意图为 ![]() , 则X原子的最外电子层上有个电子,原子核内有
个质子;另一元素Y的原子结构示意图为
,它形成的离子有 个电子层,XY两元素形成的化合物的化学式可表示为 。
, 则X原子的最外电子层上有个电子,原子核内有
个质子;另一元素Y的原子结构示意图为
,它形成的离子有 个电子层,XY两元素形成的化合物的化学式可表示为 。
25.“非典”肆虐时期,过氧乙酸作为高效消毒剂被广泛使用。过氧乙酸(X)是一种无色透明的液体,有强烈的刺激性气味,易挥发,易溶于水,且易按下式分解:
2X=2C2H4O2+O2↑。则:⑴过氧乙酸(X)由______几种元素组成的,它的化学式是 ,其相对分子质量是 。⑵写出过氧乙酸的物理性质① ,② ,③ ,④ 。
26.镁带能在二氧化碳中燃烧生成氧化镁和单质碳,其化学方程式是 ,该反应属于化学反应基本类型中的 ,其中氧化剂是 ,反应中镁、二氧化碳、氧化镁、碳的质量比是 。
27.在A+2B=2C+D中,当A和B完全反应时,质量比为5:3,若生成C,D两种物质的质量共160克,则需要B物质的质量为_________克。
28.在一种氮的氧化物中,氮元素和氧元素的质量比是7:20,则在这种化合物里氮元素的化合价是________。
27、要使CO和CO2含有相同质量的氧元素,则CO和CO2的质量比为 。
三、实验题(本大题共20分)
29.根据下列实验装置图回答(装置用字母代号表示)
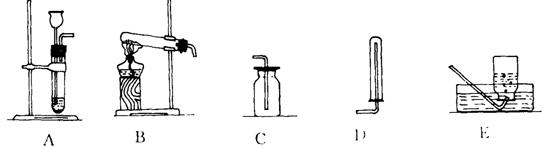
⑴写出标号仪器的名称:① ② ③ ④
⑵实验室制氧气时,应选用的发生装置是 ,收集装置是 ;用该发生装置制取氧气的化学方程式是 。
⑶实验室收集氢气应选用的装置是 ;若需证明生成的气体是氢气,可将气体_____________ _____ ,有关的化学方程式是: 。
⑷实验室用块状固体硫化亚铁(FeS)与稀硫酸反应制取硫化氢(H2S)气体。硫化氢的密度比空气大,能溶于水。根据以上知识推断:实验室制取硫化氢气体应选用的发生装置是 ,收集装置是 。
四.计算题(本大题共11分)
30.把干燥、纯净的氯酸钾和二氧化锰的混合物15.5g装入大试管中,加热制取氧气。待反应完全后,将试管冷却、称量,得到10.7g固体物质。计算:⑴制得氧气多少克?⑵原混合物中有氯酸钾多少克?⑶10.7g固体物质中含有哪些物质?各多少克?
31.将35克不纯的锌粒加入到过量的稀硫酸中(杂质不参加反应),完全反应后,得到标准状况下的氢气11.2升(标准状况下氢气的密度为0.09克/升),求锌粒中含杂质的质量分数。