初中化学总复习
第二单元 元素化合物知识(上)
例题解析:
1.完成下列化学方程式:
(1) +Zn=ZnSO4+
(2) +Na2CO3=NaOH+
(3) CuO+ = +H2O
解析:这是考查单质、氧化物、酸、碱和盐之间相互关系掌握情况的一类题。要正确地书写好化学方程式,首先要了解所给物质的类别,根据相关的反应规律和基本反应类型,确定未知物质的类别,选择相应的物质,正确书写化学式。其次,完成化学计量数的配平。由于所选取的反应规律和基本反应类型及具体物质不同,有的题目的答案就可能有多种,只要任写出一种且正确就可以了。如(1)题,Zn是金属单质,ZnSO4是盐,属置换反应。若选用“金属+酸=盐+H2”的反应规律,则可写出:H2SO4+Zn=ZnSO4+H2; 若选用“金属1+盐1=盐2+金属2”的反应规律,则可写出:CuSO4+Zn=ZnSO4+Cu,等等。(2)属复分解反应,可选用“碱1+盐1=碱2+盐2”的反应规律,只不过要注意复分解反应发生的条件,及对反应物的溶解性要求,可选的碱可以是Ca(OH)2或Ba(OH)2。(3)也属复分解反应,可选用“碱性氧化物+酸=盐+H2O”的反应规律,可选用盐酸、硫酸和硝酸等。
答案:(1) Zn+CuSO4=ZnSO4+Cu
(2) Na2CO3+Ca(OH)2=CaCO3¯+2NaOH
(3) CuO+H2SO4=CuSO4+H2O
(注:以上各题只要任写出一种且正确都可以)
2.下列各组物质中,可以存在于同一溶液中的是 ( D )
A. NaOH、MgSO4、NaCl B. BaCl2、Na2SO4、KNO3
B. AgNO3、HCl、CuSO4 D. H2SO4、Cu(NO3)2、NaCl
解析:。本题所给的物质都属于酸、碱和盐类,涉及的反应是复分解反应。因此,所给的物质间如果发生反应,即有沉淀、气体或水生成,则不能共存于同一溶液中。A中,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4;B中,Na2SO4+BaCl2=2NaCl+BaSO4↓;C中,AgNO3+HCl=AgCl¯+HNO3。
答案:D。
3.在氧气、氢气、一氧化碳、二氧化碳、甲烷、氮气等六种气体中,根据题目的要求填空(用化学式):
(1) 密度最小的气体是 ;
(2) 在空气中点燃能燃烧的气体是 ;
(3) 对人体有毒,且没有气味的气体是 ;
(4) 既能燃烧,又能使氧化铜发生还原反应的气体是 ;
(5) 本身不能燃烧,但却能支持燃烧的气体是 ;
(6) 既能用排水法,又能用向下排空气法收集的气体是 ;
(7) 只能用排水法收集的气体是 ;
(8) 只能用向上排空气法收集的气体是 ;
(9) 在空气中所占的体积分数最大的气体是 ;
(10) 通入紫色石蕊试液,试液变红的是 。
解析:本题主要考查常见的几种气体的性质,它包括物理性质和化学性质。另外,也可以从气体的收集方法及有关量的关系去考查对气体的辩识。
答案:(1) H2 (2) H2、CO、CH4 (3) CO (4) H2、CO (5) O2 (6) H2、CH4 (7) CO、N2 (8) CO2 (9) N2 (10) CO2
4.以石灰石、水、纯碱为原料,如何制取烧碱?写出有关反应的化学方程式,注明其基本反应类型。
解析:本题为制备物质的化学方程式的书写题。要正确回答这类问题,需要掌握无机物间的相互关系,有关反应规律和反应类型,及配平的知识,从要制备的物质着手,分析到相关的原料,以得到合理的制取途径和方案。烧碱的主要成分是NaOH,属于碱,制取碱有两种方法:一是用碱性氧化物跟水反应:Na2O+H2O=2NaOH;另一是用盐跟碱反应:钠盐+可溶性碱=NaOH+不溶性碱。但题给条件原料中并没有Na2O,亦很难从已知原料中制得氧化钠,故只能选取后一种方法。制备途径如下:
CaCO3![]() CaO
CaO![]() Ca(OH)2
Ca(OH)2![]() NaOH
NaOH
答案:CaCO3![]() CaO+CO2(分解反应)
CaO+CO2(分解反应)
CaO+H2O=Ca(OH)2(化合反应)
Na2CO3+Ca(OH)2=CaCO3¯+2NaOH(复分解反应)
5.一包由一种碱和一种正盐组成的固体混合物,按下列步骤进行实验:
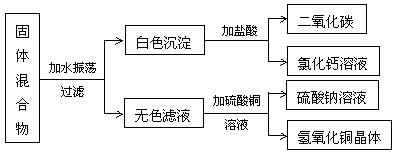
试由上述实验步骤和现象,推断组成这种固体混合物的两种可能结果:
(1) 由 和 组成;
(2) 由 和 组成。
解析:这是一道图示推断题。解题时应根据图中所提供的条件,如状态、颜色等,抓住特征反应,找出解题的突破口。本题应由两个特征反应逆推以得出结论。一是由白色沉淀加盐酸的反应产物可知,该固体为碳酸钙;另一是由无色滤液加与硫酸铜的反应可知,滤液含氢氧化钠。由于固体混合物加水得到白色沉淀和无色滤液的,故固体中应含有Ca2+、![]() 、Na+和OH- 等四种离子。这四种离子存在两种组合,故有两种可能结果:(1) 若产物为盐跟碱反应所得,则原固体混合物应由碳酸钠和氢氧化钙混合而成,溶于水时发生如下反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。(2) 若正盐与碱不发生反应,产物仅由溶解性不同而分离所得,则固体混合物由碳酸钙与氢氧化钠混合而成。由上分析可知,解题中还要有变换角度思考的能力,才能得出全面正确的结论。
、Na+和OH- 等四种离子。这四种离子存在两种组合,故有两种可能结果:(1) 若产物为盐跟碱反应所得,则原固体混合物应由碳酸钠和氢氧化钙混合而成,溶于水时发生如下反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。(2) 若正盐与碱不发生反应,产物仅由溶解性不同而分离所得,则固体混合物由碳酸钙与氢氧化钠混合而成。由上分析可知,解题中还要有变换角度思考的能力,才能得出全面正确的结论。
答案:(1) Ca(OH)2;Na2CO3 (2) NaOH;CaCO3
6.一表面被氧化的镁条6.8 g,加入盐酸使之完全反应,共得气体0.4 g。然后在得到的溶液中加足量烧碱溶液,充分反应后过滤,可得沉淀多少克?
分析:这是涉及物质间化学反应的根据化学方程式的计算。解答此类题必须弄清相关物质间的化学反应,并能正确地书写化学方程式。镁条除含镁外,还有被氧化的MgO,都能与盐酸反应,前者属置换反应,产生盐和氢气;后者是复分解反应,生成盐和水。所得的盐与烧碱反应得到的沉淀就是所需要计算的Mg(OH)2。
解:设反应的镁和生成的MgCl2的质量分别为x和y,
Mg+2HCl=MgCl2+H2
24 95 2
x y 0.4 g
24∶x=2∶0.4 g,x=4.8 g
95∶y=2∶0.4 g,y=19 g
氧化镁的质量为:6.8 g-4.8 g=2.0 g
又设氧化镁和盐酸生成的MgCl2的质量为z,
MgO+2HCl=MgCl2+H2O
40 95
2.0 g z
40∶2.0 g=95∶z,z=4.75 g
两个反应所生成的MgCl2的总质量为:19 g+4.75 g=23.75 g
设完全反应后可得到沉淀的质量为w,
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 58
23.75 g w
95∶23.75 g=58∶w,w=14.5 g
答:可得沉淀14.5 g。
综合能力训练:
一、选择题(每小题只有一个选项符合题意。)
1.下列气体中,无色无味但有毒的气体是 ( )
A. CO2 B. SO2 C. CO D. H2
2.下列说法与事实不相符的是 ( )
A. 空气中含量最多的元素是氮 B. 地壳中含量最多的元素是铝
C. 相对分子质量最小的氧化物是水 D. 硬度最大的物质是铁矿石
3.下列物质受热分解后,只得到两种氧化物的是 ( )
A. KCl B. CaCO3 C. KMnO4 D. HgO
4.能区别氢氧化钾、饱和石灰水、稀硫酸三种溶液的一种试剂是 ( )
A. 石蕊试液 B. 碳酸钠 C. 氯化铜溶液 D. 酚酞试液
5.下列关于CO2的性质叙述正确的是 ( )
A. 无可燃性,难溶于水,水溶液显碱性
B. 易溶于水,水溶液的pH值大于7
C. 比空气重,能溶于水,一般情况下不支持燃烧
D. 难溶于水,不能燃烧,有毒
6.在4个小烧杯里分别盛放质量相等的下列物质,在空气里放置一定时间后,质量增加的是 ( )
A. 浓盐酸 B. 蔗糖溶液 C. 浓硫酸 D. 浓硝酸
7.对以下化学事实的归纳和总结,你认为正确的是 ( )
A. 碱和盐的反应一定要有沉淀生成才能进行
B. 碱能与一切非金属氧化物反应
C. 酸能与所有盐反应
D. 酸能跟活泼金属反应,且一定生成盐和氢气
8.对于易燃物和易爆物的有关叙述,错误的是 ( )
A. 盛装易燃物和易爆物的容器外一定要有明显的警告标志
B. 搬运易燃物和易爆物要轻拿轻放
C. 存放易燃物和易爆物的仓库,要严禁烟火
D. 可以携带甲醇、酒精、汽油、火药等物质乘坐公共交通工具
9.下列有关反应,能产生蓝紫色火焰的是 ( )
A. 细铁丝在氧气中燃烧 B. 硫在氧气中燃烧
C. 木炭在氧气中燃烧 D. 蜡烛在氧气中燃烧
10.下列各组气体混合后点燃,不可能发生爆炸的是 ( )
A. 氢气跟空气的混合物 B. 氧气和水煤气的混合物
C. 天然气和空气的混合物 D. 二氧化碳和氧气的混合物
11.下列有关物质用途的叙述错误的是 ( )
A. CO是许多气体燃料的主要成分,也是冶金工业上常用的还原剂
B. 石灰石是制取生石灰和水泥的重要原料
C. 干冰可用来保存易腐败的食物
D. 氢氧化钠常用作中和土壤酸性的物质
12.下列物质分解的产物中,既有氧化物,又有单质的是 ( )
A. 碱式碳酸铜 B. 氯酸钾 C. 碳酸钙 D. 高锰酸钾
13.下列各组固体混合物中,可以用溶解、过滤的方法加以分离的组是 ( )
A. 氯化铁和氢氧化钙 B. 氯化钙和硝酸铜
C. 碳酸钙和氧化铁 D. 二氧化锰和氯化钾
14.下列各组气体,均可用固体氢氧化钠干燥的是 ( )
A. H2、O2、SO2 B. CO、CO2、CH4
C. H2、O2、CO D. He、HC1、N2
15.下列各组物质中,在水溶液里能够大量共存的是 ( )
A. KC1、Na2CO3、BaCl2 B. KNO3、AgCl、HNO3
C. BaCl2、H2SO4,Na2CO3 D. CaCl2、Cu(NO3)2、FeCl3
二、填空题
16.铁锈的主要成分是 ,将生锈的铁钉放入足量稀硫酸中,首先看到铁锈溶解,溶液呈 色,反应的化学方程式为: 。
17.氢气、一氧化碳、甲烷、硫粉,分别在空气中燃烧,生成物能使无水硫酸铜变蓝的是 ;生成物能使紫色石蕊试液变红的是 。
18.已知某无色溶液中含有硫酸,则该溶液中还可能含有 。
A. CuSO4 B. CaO C. ZnSO4 D. Cu(OH)2
上述物质不能存在于某无色溶液中的原因,能用化学方程式表示的,请写出化学方程式:① ;② 。
19.某地湖泊里含有丰富的Na2CO3,该地的岩石构成是石灰岩(主要含CaCO3),利用当地资源可生产出供工业用的烧碱。请写出制备过程中的有关反应的化学方程式:
① ;② ;③ 。
20.今有失去标签的碳酸钠溶液、氯化钡溶液和盐酸,现拟用一种试剂一次鉴别它们。学生甲选用一种酸溶液,学生乙选用一种钾的正盐溶液,学生丙选用了一种有色溶液,结果三人都成功了。而甲、乙、丙三个学生选用的试剂名称分别为:甲 ,乙 ,丙 。
三、推断题
21.X、Y、Z三种物质有如图所示的转化关系。
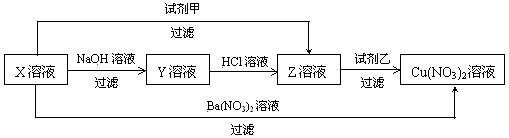
试推断:
(1) X的化学式是 ,Z的化学式是 。
(2) 试剂甲是 ,试剂乙是 。
(3) 写出由Y ® Z的化学方程式为 。
四、计算题
22.把15 g不纯硫酸钠样品(杂质不溶于水)放入85.8 g水中配成溶液,过滤后向滤液中加入10%的氯化钡溶液208 g,恰好完全反应。求:
(1) 滤液中溶质的质量分数;
(2) 样品中硫酸钠的质量分数。
答 案
综合能力训练:
一、1. C 2. D 3. B 4. B 5. C 6. C 7. A 8. D 9. B 10. D 11. D 12. D
13. D 14. C 15. D
二、16. Fe2O3;黄;Fe2O3+3H2SO4=3H2O+Fe2(SO4)3
17. 氢气、甲烷;一氧化碳、甲烷、硫粉
18. C;CaO+H2SO4=CaSO4+H2O;Cu(OH)2+H2SO4=CuSO4+2H2O
19. ① CaCO3![]() CaO+CO2 ② CaO+H2O=Ca(OH)2
③ Na2CO3+Ca(OH)2=CaCO3¯+2NaOH
CaO+CO2 ② CaO+H2O=Ca(OH)2
③ Na2CO3+Ca(OH)2=CaCO3¯+2NaOH
20. 甲:稀硫酸;乙:碳酸钾;丙:紫色石蕊试液
三、 21. (1) X:CuSO4;Z:CuC12
(2) 甲:BaC12;乙:AgNO3
(3) Cu(OH)2+2HCl=CuCl2+2H2O
四、 22. 解:设样品中硫酸钠的质量为x,
m(BaCl2)=208 g×10%=20.8 g
Na2SO4+BaCl2=2NaCl+BaSO4↓
142 208
x 20.8 g
142∶x=208∶20.8 g,x=14.2 g
溶液中硫酸钠的质量分数为:![]() ×100%=14.2%
×100%=14.2%
样品中硫酸钠的质量分数为:![]() ×100%=94.7%
×100%=94.7%
答: (1) 滤液中溶质的质量分数为14.2%,(2) 样品中硫酸钠的质量分数为94.7%。