![]()
|
|
学科:化学 |
| 教学内容:质量守恒定律 |
【基础知识精讲】
1.质量守恒定律涵义:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和.例如:参加反应P和O2的质量总和等于生成物P2O5的质量.
2.解释:化学反应前后元素的种类没有改变,原子的个数没有增减,原子质量也没有改变,因此质量守恒.
3.实质:参加化学反应的物质的分子被分裂成原子,原子重新排列组合成新的分子过程.
【重点难点解析】
正确理解质量守恒定律的内容,尤其是抓住关键的词语.①概念中“参加化学反应的”;②概念中的“质量总和”;③适用范围:化学变化而不是物理变化
例1 若有a克KClO3与 b克 MnO2的混合物,加热到质量不再减少为止,得到剩余固体C克,则反应生成O2的质量是 克,同时会生成氯化钾 克.
分析 KClO3在 MnO2催化作用下生成 KCl和O2,而MnO2在化学反应前后其质量和化学性质都不改变.剩余固体是KCl和MnO2的混合物,根据质量守恒定律,MO2=MKClO3-MKCl
解答 (a+b-c)克 (c一b)克
例2 将一定质量的镁条在空气中点燃,完全燃烧后,生成MgO的质量与镁条相比,是不变,增大还是减小?为什么?
分析 Mg在空气中与O2化合生成MgO,遵循质量守恒定律.
Mg+O2![]() MgO
MgO
解答 增大.根据质量守恒定律,反应后生成MgO的质量,必定等于镁条的质量和参加反应的氧气质量之和,所以 MgO的质量比镁条的质量增大了.
例3 化学反应前后肯定没有变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④参加化学反应各物质的质量总和 ⑤物质的种类 ⑥原子的种类
A①④⑥ B.①③⑤ C.①③④⑥ D.①③④⑤⑥
分析 质量守恒定律的实质是参加化学反应的物质的分子被分裂成原子,原子重新排列组合成新的分子的过程.故反应前后原子种类、数目、各物质质量总和、元素的种类不变.
解答 选C.
例4 某物质在氧气中燃烧后只生成水和二氧化碳,关于该物质的组成,下列说法中正确的是( )
A.一定含有C、H、O三种元素
B.一定含有C、H元素,不含O元素
C.一定含有C、H元素,可能含有O元素
D.可能含有C、H、O元素
分析 从燃烧产物水和CO2的组成来看,共含有三种元素,即碳、氢、氧元素.根据质量守恒定律,化学反应前后元素的种类不会改变,可知反应物中必定也含有碳、氢、氧三种元素.由于可燃物是在氧气中燃烧的,即氧气中肯定含有氧元素,而且也只含氧元素,所以可燃物中就一定含有碳、氢元素,而是否含氧元素就不能确定了.
解答 应选(C)
【难题巧解点拨】
例1 某有机物4.6克完全燃烧,需耗氧9.6克,生成CO28.8克,水5.4克,试判断该有机物中( )
A.只含C、H元素 B.只含C、H、O元素.
C.不只含C、H、O元素 D.不含氧元素
分析 本题须通过计算来判断该有机物中所含元素.根据质量守恒定律,可知该有机物中含有C、H两种元素,关键是判断该有机物中有无氧元素和其它元素.计算可知:
8.8gCO2中含C质量
8.8g×![]() =2.4g
=2.4g
O质量 8.8g-2.4g=6.4g
5.4gH2O中含H质量
5.4g×![]() =0.6g
=0.6g
O质量 5.4g-0.6g=4.8g
∵产物中C、H两种元素的质量总和为:24g+0.6g=3.0g<4.6g
∴该有机物中不只含有C、H两种元素
又∵产物中氧元素的质量总和为6.4g+4.8g=11.2g>9.6g
∴该有机物中肯定含有氧元素
又 ∵4.6g-3.0g=11.2g-9.6g(或∵4.6g+9.6g=8.8g+5.4g)
∴该有机物中不可能含有其它元素.
解答 选B..
例2 将 A、B、C三种物质各10克,加热进行化合反应生成D(其中B是催化剂),当A已完全反应后,测得生成的D为16克.反应后的混合物中B与C的质量比为( )
A.5∶1 B.5∶2 C.5∶3 D.4∶1
分析 依题意:A + C ![]() D
D
反应前:10克 10克
参加反应:10克 x=6克 16克
剩余:0克 4克 16克
反应后B与C质量比为10克∶4克=5∶2
解答 选C
例3 用a克KClO3和b克MnO2混合加热一段时间后放出O2,测得剩余固体中MnO2占20%,则放出的O2质量为( )
A.(a-b)g B.(a-0.2b)g
C.(a-4b)g D.(a-0.8b)g
分析 ∵MnO2是催化剂,反应前后质量都是b克,∴剩余固体的质量为b÷20%=5b
根据质量守恒定律,mO2=m反应前总质量-m反应后剩余固体质量
=a+b-5b=a-4b
解答 选(C)
例4 已知反应3A+2B=2C+D,A、B两物质完全反应时质量比为3∶4,若生成C和D共140克,则该反应消耗B的质量为( )
A.60克 B.80克 C.90克 D.120克
分析 根据质量守恒定律,反应物A和B的质量总和与生成物C和D的质量总和相等,设消耗B的质量为x,则:3A+ 2B= 2C+ D
3 ∶ 4 ∶ 7
x 140克
![]() ×140克=80克
×140克=80克
解答 选(B)
【典型热点考题】
例1 在A+2B=C+2D的反应中, 9.8克A和8克B完全反应生成14.2克C,同时得到 克D.
分析 根据质量守恒定律,参加反应A和B物质质量总和等于生成物C和D质量总和.
即:9.8克+8克=14.2克+x ∴x=3.6克
解答 9.8克+8克=14.2克+x X=3.6g
例2 在密闭的容器中加热蔗糖产生炭黑和水,这一事实说明了( )
A.蔗糖是炭黑和水组成的纯净物
B.蔗糖是炭黑和水组成的混合物
C.蔗糖分子是由碳元素和水分子构成的
D.蔗糖是由碳元素、氢元素和氧元素组成的
分析 生成碳黑是由碳元素组成,而水是由氢元素和氧元素组成的.根据质量守恒定律,反应前后元素种类不变.故蔗糖是由碳、氢、氧三种元素组成的.
解答 选D.
例3 试从化学变化实质的角度,驳斥“水变油”的谎言.(提示:原油的成份中,主要含有C、H、O)
解答 水是由氢、氧两种元素组成,而原油主要含有C、H、O三种元素,根据质量守恒定律,水不可能变成含碳元素的原油.
例4 遵循质量守恒定律 2XY2+Y2=2W中的“W”的化学式是( )
A.X2Y B.XY2 C.XY3 D.X3Y
分析 反应前后,原子的个数、种类不变,反应前共有2个X原子,6个Y原子,反应后W前有系数2 ∴W中有1个X原子和3个Y原子.
解答选C..
例5 A、B、C三种物质各15克,它们发生反应时,只生成30克新物质D,若增加10克C,A与C恰好完全反应,则A与B参加反应的质量比为( )
A.1∶1 B.2∶1 C.2∶3 D.3∶2
分析 理解质量守恒定律的关键,是强调“参加反应”,反应物的质量总和不包括其中过量部分,即没有参加反应的部分.依题意,在反应中A+B+C=D中,很明显各15克,A、B、C三种物质肯定有物质过量,即没有参加反应.25克C恰好能与15克A完全反应,那么当C为15克时,可设参加反应的A的质量为x
A+ B+C → D 根据质量守恒定律可知,参加反应的
15 25 B的质量应为30克-9克-15克=6克
x=9克 15克
故A与B参加反应的质量比为9∶6即3∶2.
解答 选D.

【同步达纲练习】
一、选择题(6分×10分=60分)
1.在化学反应A+2B=C中,1.5克A与足量的B充分反应后生成9.5克C,参加反应的B的质量为( )
A.3克 B.9.5克 C.8克 D.4克
2.在C+O2![]() CO2中,参加反应的碳的质量和生成的CO2的质量关系是( )
CO2中,参加反应的碳的质量和生成的CO2的质量关系是( )
A.C的质量<CO2的质量 B.C的质量=CO2的质量
C.C的质量>CO2的质量 D.无法判断
3.根据化学方程式:3AB+C2B3=2C+3X确定X的化学式为( )
A.AB B.AB2 C.A3B2 D.A2B3
4.下列叙述正确的是( )
A.因为“质量守恒”,所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等.
B.铁丝在氧气中燃烧后,生成物的质量比铁丝的质量增加了.
C.100克酒精和100克水混合在一起后,质量等于200克,符合质量守恒定律.
D.H2和O2形成混合物的质量等于其反应后生成水的质量.
5.agKClO3与bgMnO2混合加热完全反应后得到KCl质量为cg,则生成O2的质量为 ( )
A.a+b-c B.a-c C.a-b D.a-b-c
6.某反应A+B=C+ D,每当25克A和10克B恰好完全反应时,则生成5克 C,那么生成6克D时,参加反应的A物质的质量应是( )
A.5g B.10g C.20g D.15g
二、填空题(4×10=40分)
7.参加化学反应的各物质的 等于反应后生成的各物质的 ,这个规律叫 做 .因为在化学反应前后, 没有改变, 没有增减, 没有变化.
8.某化合物在空气中燃烧后只生成CO2和H2O,判断该化合物中一定含有 元素,可能含有 元素.
9.蜡烛燃烧前的质量为ag,燃烧后的质量为bg,生成的CO2为cg,水蒸气为dg,则产物共 克,参与反应的O2的质量为 g.
10.黑火药是我国的四大发明之一,距今已有一千多年的历史.黑火药爆炸的原理可用下式表示:2KNO3+3C+S![]() K2S+N2↑+3x↑,根据质量守恒定律,推断X的化学式 .
K2S+N2↑+3x↑,根据质量守恒定律,推断X的化学式 .
【素质优化训练】
1.含杂质的镁条3克,在氧气中充分燃烧后生成4克MgO,则镁条中镁元素的质量分数( )
A.20% B.40% C.60% D.80%
2.实验室用加热KClO3和MnO2的混合物制取O2,在这一过程中,MnO2在固体混合物中的质量分数变化情况,与时间(t)的函数关系,正确的是( )
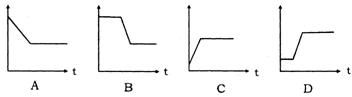
3.在氧气中燃烧某物质4.6g,生成5.4g水和8.8gCO2,求:(1)通过计算确定该物质中是否含有氧元素.(2)组成该物质的各元素的质量比.
【知识验证实验】
某同学做用白磷燃烧验证质量守恒定律的实验时,发现锥形瓶裂开,运用你所学过的知识,分析可能的原因是什么?
【知识探究学习】
实验与思考:甲同学取mg铜绿和铜粉的混合物,放入试管中在空气中充分灼热,完全反应后冷却、干燥、称量,发现剩余固体的质量仍为mg.乙同学认为甲同学所取固体混合物的质量不变是没有发生反应的结果.你认为是这样的吗?请解释原因.

参考答案:
【同步达纲练习】
一、1.C 2.A 3.B 4.B 5.B 6.A
二、7.质量总和,质量总和,质量守恒定律,原子种类,原子数目,原子质量 8.C、H;O 9.c+d,c+d+b-a 10.CO2
【素质优化训练】
1.D 2.D 3.含有氧元素;C∶H∶O质量比=12∶3∶8
【知识验证实验】
(1)锥形瓶底未铺上一层细沙
(2)白磷接触到锥形瓶壁
【知识探究学习】
解答:乙同学观点不对.因为铜绿受热要分解生成CuO、CO2和H2O,铜粉在空气中加热生成CuO,两种物质都发生了反应,只不过CO2和H2O以气体形式扩散了,但同时CuO中增加氧元素的质量,两者质量正好相等.
