初中化学中考复习资料
综 合 训 练
一,选择题:(下列各题只有一个答案符合题意.请将正确答案的字号填在各小题的括号中,每小题2分,共18分)
1.下列现象中,属于化学变化的是 ………………………………( )
A.海水蒸发 B.冰雪融化 C.动植物腐败 D.山体滑坡
2.下列关于物质用途的叙述,易造成重大伤亡事故的是…………( )
A.活性炭可做冰箱除臭剂 B.庆典活动可使用大量氢气球 C.熟石灰可用来粉墙 D.钛合金可做轮船外壳
3.反应A+2B=C+2D中,若29克A与49克B全反应生成60克C,已知D的相对分子质量为 18,则A的相对分子质量是 ………………………( )
A.58 B.49 C.29 D、85
4.下列说法正确的是 …………………………………………………( )
A.分子、原于都在不断地运动着
B.任何原子的原子核都是由质子和中子构成的
C.二氧化硫分子是由硫元素和氧元素组成的
D.分子是保持物质性质的最小粒子
5.由Na2CO3和CaCO3组成的混合物,其中碳元素的质量分数为11.64%,则下列各项中:①钠元素的质量分数 ②钙元素的质量分数 ③氧元素的质量分数④CaCO3的质量分数 ⑤Na2CO3的质量分数 ⑥Na2CO3和CaCO3的质量比,其中能确定的是 ………………………………………………………………( ) A.都不能确定 B.只有③能确定 C.只有④⑤⑥能确定 D.都能确定
6.下列化学实验基本操作中,正确的是……………………………( )
A.稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中
B.酒精灯使用完毕,用灯帽盖灭
C.用滴管滴加液体时,将滴管伸入试管中
D.不慎将硫酸洒在皮肤上,用氢氧化钠溶液中和
7.在氧化铜和铁粉的混合物中,加入一定量的稀硫酸并微热,反应停止后滤出不溶物,再向滤液中插入铁片,铁片上无变化,则滤液中……( )
A.一定含有硫酸亚铁,可能含有硫酸铜
B.一定无硫酸铜,可能含有硫酸亚铁
C.一定含有硫酸亚铁和硫酸铜
D.一定无硫酸铜,一定含有硫酸亚铁
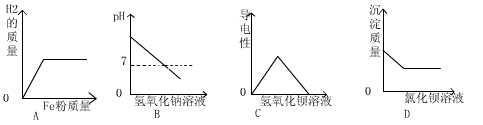 |
8. 向四个盛有一定质量稀硫酸的烧杯中分别加入下列四种物质,下列图象表示的变化关系正确的是…………………………………………………………………( )
9. 要除去氮气中混有的少量H2、CO、CO2,得到干燥的氮气(假设每步反应反应都是完全的),通过下列试剂的先后顺序中,正确的是 ①浓硫酸 ②苛性钠溶液 ③灼热的氧化铜
A.①②③ B.②①③ C.③②① D.②③①
二、填空题(每空格1分,共8分)
10.大麻是严重危害人体的毒品之一,其化学式为C12H30O2,它是由 种元素组成的,每个分子中共有 个原子。
11.某固体粉末与氯酸钾混合共热,发现氯酸钾分解速率明显增大。由此得出粉末在该反应中(填“一定是”、“可能是”、“不是”)__ __催化剂。
12.在2Na + 2H2O 2NaOH + H2↑中,被氧化的物质是
。
13.根据下列结构示意图,用序号回答:
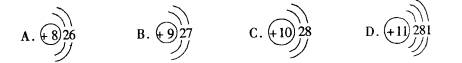
上述微粒有两种能形成X2Y型离子化合物,它们是 。
14.用煤火取暖或使用燃气热水器冲凉,都可能发生煤气中毒,请回答:
①煤气的有毒成份的化学式是 。
②煤燃烧时产生煤气的条件是 。
③煤气使人中毒的生理过程是
三、推断题。(6分)
15. 如图,在河边有A,B,C,D四家工厂向河中排放废水,若每个工厂的废水中含有NaOH、HCl、MgCl2、Na2CO3四种物质中的一种,某中学环保小组对该河流的污染状况进行检测,发现:A处河水能使紫色石蕊试液变蓝色;B处河水出现白色浑浊;D处河水有大量气泡产生;E处河水澄清,经测定pH为7。
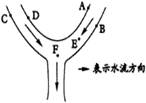 (1)试推断B工厂排放的废水中含污染物是_ ___。
(1)试推断B工厂排放的废水中含污染物是_ ___。
(2)F处河水中含有的溶质主要是_ ___。
(3)D处发生的化学反应方程式为
16.已知某固体粉末是NaCl、BaCl2、CuSO4、Na2SO4之一或几种的混合物,做以下实验:
(1)粉末加水,振荡后呈浑浊,过滤,滤液无色;当向溶液中加入AgNO3溶液时,产生白色沉淀,继续加入足量的稀HNO3,沉淀不消失。
(2)将滤出的沉淀加足量的稀HCl时,沉淀不消失,原粉末中一定有 ,一定不含有 ,可能含有 。
四、实验题 :共12分
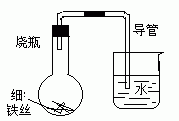 17.某化学研究小组为探究某化学问题,设
17.某化学研究小组为探究某化学问题,设
计了如下的探究实验:
在A、B、C、三只小烧瓶中分别放入干燥的细铁丝、浸过清水的细铁丝、被清水完全浸没的细铁丝,然后装配成右图所示的三套装置,每隔一段时间测量导管中水面上升的高度。结果如下表所示(表中所列数据为导管水面上升的高度/cm):
| 时间/h | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| C瓶(盛完全浸在蒸馏水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
(1)如果请你为该探究活动拟标题,你的建议是(写课题名称)
____ ______。
(2)实验前,如何检验该实验装置的气密性?
__________ ______。
(3)通过实验得到的数据,可以得到的结论是:
(4)通过上面的探究实验,从理论上来说怎样防止铁生锈?
18. 浓硫酸与铜在加热条件下能发生反应:
Cu + 2H2SO4===CuSO4 + SO2↑+ 2H2O
有人设计了两种用铜制取硫酸铜的方案:
① Cu → CuSO4
; ②Cu![]() CuO
CuO![]() CuSO4
CuSO4
这两种方案中,你认为 (填序号)较好,该方案好的理由是
19. 利用纯净、干燥的氢气还原灼热的氧化铜来测定水的组成。实验装置由A、B、C、D组成(氢气发生装置省略,未画出)。回答下列问题:
CuO
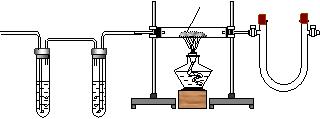
CaCl2
A B C D
(1)如果某学生用锌和较浓的盐酸制取氢气,他用装置A、B是为了得到纯净、干燥的氢气,在装置A中通常盛放__ __溶液,为了除去__ _;在装置B中应盛放的试剂是__ __,为了除去__ __。
(2)若实验前后,称量结果如下,装氧化铜的玻璃管的质量减少了6.4g,装氯化钙的U型管的质量增加了7.2g。根据上述实验数据写出水中氢、氧两种元素质量比的原始计算式__ __。
(3)在装置B中,有一处明显的错误,说出改正的方法
。
五.计算题 (6分)
20.已知硝酸钾10℃时溶解度为20g。向一定量溶质的质量分数为31.5%的HNO3溶液中加入溶质的质量分数为28%的KOH溶液至恰好完全反应, 反应后溶液冷却到10℃时析出晶体41.2g(不含结晶水)。试求:
(1)反应冷却到10℃时,溶液中溶质的质量分数。
(2)KOH溶液的质量是多少。
综 合 训 练 (八)参考答案
一、选择题:
1、C 2、B 3、A 4、A 5、D
6、B 7、D 8、A 9、C
二、填空
10、三 44 11、可能是
12、Na 13、A D或D A
14、① CO ② 氧气不充足
③ 一氧化碳与血液中的血红蛋白化合,使血红蛋白不能与氧气化合。
三、推断题
15、① MgCl2 ②NaCl
③2HCl + Na2CO3 2NaCl + H2O +
CO2↑
16、BaCl2、Na2SO4; CuSO4; NaCl
四、实验题
17、(1)探究铁生锈的条件(或影响钢铁生锈的条件); (2)将导管末端放入水中,用手握住烧瓶一段时间,观察浸入水槽 的导管口是否冒出气泡;
(3)铁生锈是铁、氧气、水共同作用的结果;
(4)不让铁与水、氧气共同接触
18、② ; 节约药品,无污染
19、①NaOH 、HCl气体、浓硫酸、水蒸气
②(7.2g-6.4g):6.4g
③B装置中左边导管应伸入液面以下,右边导管应只伸出塞子一点
五、计算
20、(1)冷却到10℃时,有晶体析出,所以溶液是饱和的。
溶质的质量分数为![]() ×100% = 16.7%
×100% = 16.7%
(2)设KOH溶液的质量为x, HNO3溶液的质量为Y
KOH + HNO3 KNO3 + H2O
56 63 101 18
0.28x 0.315y
56 / 63 = 0.28x / 0.315y ∴x = y
各项计算结果如下:
KOH + HNO3 KNO3 + H2O
56 63 101 18
0.28x 0.315x 0.505x 0.09x
反应后溶液中水的质量为:0.72x + 0.685x +0.09x = 1.495x
100g / 20g = 1.495x / (0.505x -41.2g)
x = 200g
答:略