第三单元 初中化学总复习化学基本计算(上)
例题解析:
1.常温时,硫酸镁的溶解度是54 g。若称取19 g硫酸镁投入到31 g蒸馏水中,充分搅拌,其溶液中硫酸镁的质量分数为 。
解析:根据溶解度的定义,一定量的溶液里,溶解溶质的量不能超过物质的溶解限度,即溶质不包括未溶解的部分。31 g水中最多可溶解16.74 g MgSO4。因此,如果按题给的溶质和水的量进行如下计算:
![]() ×100 g=38%
×100 g=38%
显然是错误的。必须按硫酸镁的溶解度数据进行如下计算才是正确的。
![]() ×100 g=35.1%
×100 g=35.1%
答案:35.1%
2.某甲醛溶液中氢元素的质量分数为10%,则碳元素的质量分数为多少?(甲醛的化学式为HCHO)
分析:本题是一道利用化学式计算物质中某元素质量分数的题目。题中物质并非纯净物,碳氢元素不能依据化学式直接列比例式计算。由于甲醛化学式中H、O原子个数为2∶1,与水的组成相同,故可采用特殊方法快速解题。
解:HCHO可写作C(H2O),可假想由HCHO和H2O构成的溶液的化学式为Cn(H2O)m,
w(H2O)=w(H2)×![]() =10%×
=10%×![]() =90%
=90%
w(C)=w(Cn)=1-w(H2O)=1-90%=10%
答:碳元素的质量分数是10%。
3.在稀硫酸和硫酸铜的混合溶液中加入足量的铁粉,完全反应后剩余固体的质量与所加铁粉的质量相等,求混合溶液中硫酸和硫酸铜的质量比。
分析:本题为无数据计算题。求解此类题要从基本知识着手,仔细审题,运用化学知识,分析出隐含条件,找出解题的突破口。本题的关键是得出:反应中生成铜的质量应等于跟稀硫酸反应的铁的质量以及与硫酸铜反应的铁的质量之和,并以此列式进行求解。
解:设与铁反应的H2SO4和CuSO4分别为98x和160y,与此相关的量如下所示:
Fe + H2SO4 = FeSO4 + H2↑
56x 98x
Fe + CuSO4 = FeSO4 + Cu
56y 160y 64y
56x+56y=64y
y=7x
硫酸和硫酸铜的质量比为:98x∶160y=98x∶160×7x=7∶80
答:硫酸和硫酸铜的质量比为7∶80。
4.将一定质量的氧化铜粉末加入100 g溶质的质量分数为14%的硫酸溶液中,微热至氧化铜全部溶解;再向该蓝色溶液中加入铁粉20 g,充分反应后过滤、烘干,得到干燥固体的质量仍为20 g。试计算:
(1) 原加入的氧化铜的质量;
(2) 最后得到的溶液中的溶质的质量分数。
分析:本题有两个反应的剩余物判断:一是一定质量的氧化铜与硫酸反应,硫酸是否有剩余;另一是生成的硫酸铜与铁粉反应,铁粉是否过量。应知道CuSO4中的Cu被完全置换出来,最后得到的溶液中的溶质是FeSO4。解答本题可用到两个某元素的原子守恒:即在氧化铜与硫酸反应中析出铜的质量等于CuSO4中Cu元素的质量,也等于CuO中Cu元素的质量;铁与硫酸反应中,FeSO4与参与反应的硫酸中的S元素相同。具体解题思路可用下列图示表示,并从解题过程中看看设求知数的技巧。
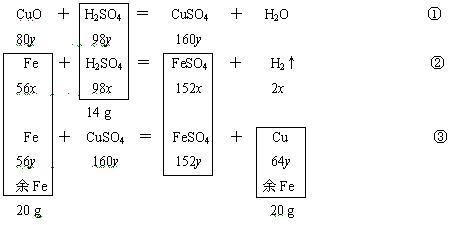
解:由Fe+CuSO4=FeSO4+Cu 固体质量增加
56 64 64-56=8
可知,该反应使固体的质量增加,要使反应前后固体的质量保持不变,则硫酸在与氧化铜反应后有剩余,这样才有铁与硫酸反应生成氢气以使固体的质量减少,以抵消上述反应的固体增重。
硫酸的质量为:100 g×14%=14 g
设反应生成的H2及析出的Cu的质量分别为2x和64y,(由此而得出的其它物质的数据见上面的图示)
由题意知,消耗铁的质量应等于析出铜的质量,可得下式:
56x+56y=64y,7x=y ①
98x+98y=14 g,x+y=![]() g
②
g
②
联立二式可得:y=![]() g
g
x=![]() g
g
m(CuO)=80y=80×![]() g=10 g,
g=10 g,
m(FeSO4)=152( x+y)=![]() g
g
m(H2)=2x=2×![]() g=
g=![]() g
g
m(Fe)=56( x+y)=8 g
w(FeSO4)=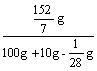 ×100%=19.7%
×100%=19.7%
答:(1) 氧化铜为10 g,(2) 生成溶液中的溶质的质量分数为19.7%。
5.把47 g由一种非金属单质和一种氧化物组成的黑色固体混合物隔绝空气加热,充分反应后,称得剩余固体质量为36 g,该固体也是由一种单质和一种氧化物组成。向此剩余固体中加入100 g稀H2SO4恰好完全反应,过滤后所得滤渣呈红色。回答:
(1) 原混合物由什么物质组成?
(2) 原混合物中含有单质多少克?
(3) 过滤后所得的滤液需要蒸发掉多少克水,才能形成t℃时的饱和溶液?( t℃时此溶液中溶质的溶解度为16 g)
分析:此是涉及元素化合物性质的计算题。由黑色固体混合物隔绝空气加热可得红色固体,可知此混合物由CuO和C组成,生成物为Cu和CO2。由剩余固体能与稀硫酸反应,说明上述反应不完全,剩余固体中还混有CuO。
解:(1) 原混合物由CuO和C组成。
(2) 根据质量守恒定律,
m(CO2)=47 g-36 g=11 g
设原混合物中含碳的质量,以及与C反应的CuO的质量分别为x和y,
C+2CuO![]() CO2↑+2Cu
CO2↑+2Cu
12 160 44
x y 11 g
12∶x=44∶11 g,x=3 g
160∶y=44∶11 g,y=40 g
剩余CuO的质量为:47 g-(40 g+3 g)=4 g
(3) 设生成的CuSO4的质量为z,
CuO+H2SO4=CuSO4+H2O
80 160
4 g z
80∶4 g=160∶z,z=8 g
反应后所得溶液的质量为:4 g+100 g=104 g
反应后所得溶液中水的质量为:4 g+100 g-8 g=96 g(即溶液的质量守恒)
设需蒸发掉质量为w的水才能恰好形成饱和溶液:
100 g∶16 g=(96 g-w)∶8 g,w=46 g
答:(1) 原混合物由CuO和C组成,(2) 原混合物中含碳3 g,(4) 蒸发掉滤液46 g,便可形成t℃时的饱和溶液。
综合能力训练:
一、选择题(每小题只有一个选项符合题意。)
1.下列化合物中相对分子质量最大的是 ( )
A. KMnO4 B. CuSO4·5H2O C. Cu2(OH)2CO3 D. HgO
2.跟7.9 kg NH4HCO3含氮量相当的NH4NO3的质量是 ( )
A. 8 kg B. 2 kg C. 4 kg D. 16 kg
3.金属钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,将2.3 g金属钠投入97.7 g水中,充分反应后,所得的溶液中溶质的质量分数 ( )
A. 等于2.3% B. 等于4% C. 小于4% D. 大于4%
4.质量相等的下列金属跟足量的稀硫酸反应,放出氢气最多的是 ( )
A. Na B. Mg C. Al D. Zn
5.使氢气通过灼热的过量氧化铜粉末时,生成7.2 g水,反应后固态物质比原来减少了
( )
A. 7.2 g B. 25.6 g C. 32 g D. 6.4 g
6.含某种杂质的氧化铁粉末,则知其含氧32.5%,这种杂质可能是 ( )
A. CuO B. Cu C. Fe D. SiO2
7.CO和CO2的混合气体含碳元素36%,取5 g此气体,使其通过足量的灼热CuO后,将所得气体通入足量的澄清石灰水中,得到白色沉淀为 ( )
A. 5 g B. 10 g C. 15 g D. 20 g
8.病人输液时常用的葡萄糖的化学式为C6H12O6,下列关于葡萄糖的叙述中错误的是
( )
A. 葡萄糖的相对分子质量为180
B. 葡萄糖中C、H、O元素的质量比是6∶1∶8
C. 葡萄糖中C、H、O原子个数为1∶2∶1
D. 葡萄糖中氢元素的质量分数最大
9.18℃时,某物质的溶解度是25 g。在此温度下,向30 mL水中加入10 g该物质(不含结晶水),充分溶解后,所得溶液中溶质的质量分数是 ( )
A. 33.3% B. 25% C. 20% D. 10%
10.在化合物X2Y和YZ2中,Y的质量分数分别为40%和50%,则X2YZ3中Y的质量分数是 ( )
A. 25% B. 30% C. 35% D. 20%
11.下列关于质量相同的CO和CO2的叙述正确的是 ( )
A. 氧元素的质量比为11∶4 B. 氧原子的个数比为1∶2
C. 碳元素的质量比为1∶1 D. 分子个数比是11∶7
12.金属元素M的相对原子质量为70,它在化合物中只有一种化合价。已知它的磷酸盐的相对分子质量为165,则它的硫酸盐的相对分子质量为 ( )
A. 106 B. 236 C. 428 D. 不知道化学式,无法计算
13.一种盐酸盐通过实验分析后测得,它含氯的质量分数是47.65%。这种物质是 ( )
A. NaCl B. CaCl2 C. KCl D. HgCl2
14.一定量的12%的氯化钾溶液,当加热蒸发掉120 g水后,溶液仍未达到饱和状态,但溶质质量分数增大了一倍,则溶液中溶质的质量是 ( )
A. 28.8 g B. 24 g C. 14.4 g D. 12 g
15.将铜粉和炭粉的混合物在空气中充分燃烧后,最终所得黑色物质与原混合物质量相等,则炭粉在原混合物中的质量分数为 ( )
A. 20% B. 80% C. 15.8% D. 84.2%
二、填空题
16.① CO2,② CO,③ CH4三种含碳的物质,按所含碳元素的质量分数由高到低排列顺序排列为 (填序号)。
17.把w g KClO3和1.5 g MnO2混合加热后,得到残留物质n g,则生成氧气的质量为
g(用w、n表示)。
18.在食盐中加入适量碘酸钾(KIO3)可以有效地防止碘缺乏病。KIO3的相对分子质量为
,KIO3中钾元素、碘元素、氧元素的质量比为 。现在我国食盐中加碘含量为每千克食盐中含碘0.035 g,相当于每千克食盐中含碘酸钾 g(精确到0.01)。
19.有某氧气和二氧化硫的混合气体,其氧元素的质量分数为60%,则该气体中氧气与二氧化硫的质量比为 。
20.向20 g质量分数为10%的NaOH溶液中加入30 g质量分数为20%的NaOH溶液,则混合液中NaOH的质量分数为 。
三、计算题
21.将20.0 g不纯的氯化钡粉末(杂质不溶于水,也不能反应)放入一定量硫酸钠溶液中恰好完全反应,反应后得质量分数为12.0%的溶液97.5 g。求:
(1) 反应后溶液中溶质质量;
(2) 混合物中氯化钡的质量分数;
(3) 反应前硫酸钠溶液质量。
答 案
综合能力训练:
一、1. B 2. C 3. D 4. C 5. D 6. D 7. C 8. D 9. C 10. A 11. D 12. C
13. C 14. A 15. A
二、 16. ③②①
17. w+1.5-n
18. 214;39∶127∶48;0.06
19. 1∶4
20. 16% 提示:混合后NaOH的总质量:20 g×10%+30 g×20%=8 g
混合后溶液的质量:20 g+30 g=50 g,w(NaOH)=![]() ×100%=16%
×100%=16%
三、 21. 解:(1) 反应后溶液中溶质的质量为:97.5 g×12.0%=11.7 g
(2) 设混合物中氯化钡和生成硫酸钡的质量分别为x和y,
BaCl2+Na2SO4=BaSO4¯+2NaCl
208 233 117
x y 11.7 g
208∶x=117∶11.7 g,x=20.8 g
w(BaCl2)=![]() ×100%=80%
×100%=80%
(3) 233∶y=117∶11.7 g,y=23.3 g
硫酸钠溶液质量为:97.5 g+23.3 g-20.8 g=100 g(溶液质量守恒)
答:(1) 溶液中有11.7 g NaCl,(2) 氯化钡的质量分数为80%,(3) 硫酸钠溶液质量为100 g。