![]()
|
|
学科:化学 |
| 教学内容:核外电子排布的初步知识 |
【基础知识精讲】
一、核外电子分层排布的初步知识
1.在含有多个电子的原子里,电子的能量并不相同,故电子是分层排布的.
电子层数 一二三四五六七
离核距离 近→远
电子能量 低→高
填充顺序 先→后
2.原子结构示意图.
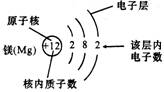
如图,镁原子的结构示意图含义
①+12 表示原子核及核内有12个质子(即原子核带有12个单位正电荷),
②弧线表示电子层
③弧线上的数字表示该电子层上的电子数
3.元素种类的划分
| 元素类别 | 最外层电子数 | 得失电子趋势 | 性质 | 结论 |
| 金属元素 | <4 | 失去最外层电子 | 较易发生化学反应 | 元素的化学性质与原子的最外层电子数有关 |
| 非金属元素 | ≥4(氢为1) | 易得电子或形成共用电子对以达到8电子稳定结构 | ||
| 稀有气体元素 | =8(He为2个) | 难得失电子 | 难发生化学反应 |
二、离子:带电的原子或原子团叫离子.
1.阳离子:失去电子的原子,带正电荷,如Na+、Mg2+、Al3+、NH+4等(质子数>电子数)
2.阴离子:得到电子的原子,带负电荷,如O2-、F-、Cl-、S2-、SO2-4等(质子数<电子数)
3.离子的形成和符号
(1)金属元素的原子容易失去最外层电子,失去m个电子就带m个单位正电荷,表示为Rm+.如铝原子Al→铝离子Al3+.

(13=2+8+3)原子结构示意图 阳离子结构示意图(13>2+8)
(2)非金属元素的原子容易得到电子,达到8电子稳定结构,得到n个电子,就带n个单位负电荷,表示为Rn-.如氧原子O→氧离子O2-.

(8=2+ 6) (8<2+8= 阴离子结构示意图
离子化合物
三、化合物按形成方式的不同划分为<
共价化合物
1.离子化合物:
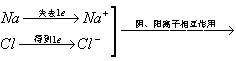 NaCl(离子化合物)
NaCl(离子化合物)
2.共价化合物
![]() 氯化氢分子(HCl)(共价化合物)
氯化氢分子(HCl)(共价化合物)
3.实验验证:Na+Cl2![]() NaCl H2+Cl2
NaCl H2+Cl2![]() HCl
HCl
【重点难点解析】
一、1~18号元素核外电子排布知识及应用
例题:按核电荷数的增加,依一定规律将1~18号元素顺次排列成下表,
运用所学的核外电子排布的初步知识,据表填空.
| 最外层电子数 电子层数 | Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ O |
| 一 二 三 | H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar |
(1)在化学反应中,第Ⅰ纵行的元素比较容易 电子;第Ⅵ纵行的元素比较容易 电子,(除H外)都通常达到8个电子的稳定结构.可见元素的化学性质主要决定于原子的 数
(2)从原子结构方面看:同一横行的元素具有相同的 数;同一纵行的元素具有相同的 数.
(3)在表中和Ne原子核外电子排布相同的两种阴离子的离子结构示意图分别为______和 ,3种阳离子的离子符号是 、 、 .
分析 按核电荷数递增顺序,画出1~18号元素的原子结构示意图,详见课本P59图3-16所示的示意图.通过比较这些元素的原子结构示意图即可解答有关问题.
解答 (1)失去;得到;最外层电子数 (2)电子层;最外层电子
![]()
二、具有相同质子数的粒子不一定是同种元素
元素是具有相同质子数的一类原子的总称,但不能认为具有相同质子数的粒子一定是同种元素,因为粒子可以是分子、质子、离子.
现举例说明具有相同质子数的粒子的几种可能情况:1.同一元素的原子和离子.如F和F-质子数都是9;2.分子和原子,如Ne、H2O的质子数都是10;3.不同的分子,如H2O、HF、NH3、CH4的质子数都是10; 4.原子和原子团,如Na和NH+4的质子数都是11;5.不同的离子,如F-和OH-的质子数都是9.
三、具有相同电子层排布的微粒不一定是同种元素的原子
例:与氖原子电子层排布相同的离子有O2-、F-、Na+、Mg2+、Al3+;与氩原子电子层排布相同的离子有S2-、Cl-.
四、构成物质的基本粒子——分子、原子、离子
有的物质是由分子构成的,如H2O、NH3、HCl、O2、H2等.有的物质是由原子构成的,如Fe、Cu、He、Ar等.有的物质是由离子构成的,如NaCl、MgF2、K2SO4等.在化学反应里,分子一定发生改变,原子一定不发生改变,离子不一定发生改变.
五、离子化合物与共价化合物的比较
| 离子化合物 | 共价化合物 | |
| 概 念 | 由阴、阳离子相互作用而构成的化合物 | 以共用电子对形成分子的化合物 |
| 组成元素 | 通常是活泼金属与活泼非金属元素 | 通常是不同种的非金属元素 |
| 形 成 | 原子得失电子,形成阴、阳离子 | 原子间形成共用电子对 |
| 构成粒子 | 由离子构成 | 由分子构成 |
| 举 例 | NaCl、CaF2、ZnSO4 | HCl、H2O、CO2 |
【典型热点考题】
例1 下列六种粒子结构示意图分别为:
(1) A、B、C、D、E共表示 种元素
(2)表示原子的粒子是 (填序号)
(3)表示阳离子粒子是
(4)表示阴离子粒子是
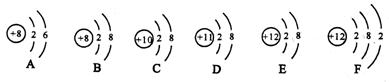
分析 元素是具有相同核电荷数的一类原子的总称,在题目所示的六种粒子中,A与B,E与F的核电荷数相同,故共代表四种元素.
在原子中质子数=电子数;阳离子质子数>电子数;阴离子质子数<电子数
解答 (1)四 (2)ACF (3)DE ()B
例2 质子数不超过18的A、B、C3种粒子,它们的核电荷数依次增大.A粒子失去3个电子后呈电中性;B粒子带2个单位正电荷,其核外电子排布和氖原子相同;C粒子得到两个电子后最外层可达到8电子稳定结构,则A、B、C三种粒子是( )
A.Mg2+、Al3+、O2- B.N3-、Mg2+、S2-
C.N3-、Mg2+、S D.Al3+、Ne、S2-
分析 根据题意,可知, B粒子是具有12个质子,核外有10个电子的粒子,即是Mg2+离子.
由三种粒子核电荷数依次增大可知,A粒子的质子数小于12,C粒子的质子数大于12,A粒子应该是具有10个电子,核内有7个质子的N3-离子,C粒子应该是具有16个质子和16个电子的S原子.
解答 应选C
例3 构成物质的粒子有①原子②离子③分子.用符号和名称分别填写下列空白:
(1)水是由 、 构成.
(2)铁是由 、 构成的.
(3)氯化钾是由 、 构成的.
分析 水是共价化合物,由水分子构成,铁是金属单质直接由铁原子构成,氯化钾是离子化合物,由离子构成,另外按题目要求在每小题前一空填写符号,后一个空填名称.
解答 (1)H2O,水分子;(2)Fe,铁原子;(3)K+、Cl-、钾离子和氯离子

【同步达纲练习】
一、选择题(6×10分=60分)
1.核外电子分层排布的主要原因是( )
A.电子的能量不同 B.电子的大小不同
C.电子的数量不同 D.电子的质量不同
2.元素的化学性质主要取决于原子结构中的( )
A.电子层数 B.最外层电子数 C.核外电子数 D.中子数
3.某微粒核外有18个电子,核内有17个质子和18个中子,这微粒是( )
A.氩原子 B.氯原子 C.氯离子 D.硫离子
4.下列各组微粒的质子数和电子数均相等的是( )
A.Na和Na+ B.F-和OH- C.Cl和Cl- D.Na+和Mg2+
5.S和S2-具有相同的( )
A.核电荷数 B.核外电子数 C.化学性质 D.电性
6.下列说法中正确的是( )
A.在多个电子的原子里,能量低的电子离核近,能量高的电子离核远
B.原子最外层电子数小于4的一定是金属元素
C.凡是质子数相同的粒子一定属于同种元素
D.最外层为8电子结构的粒子一定是稀有气体元素.
二、填表( 10分)
| 粒子名称 | 粒子符号 | 质子数 | 电子数 | 中子数 | 相对原子质量 |
| 碳原子 | 6 | 6 | |||
| Al3+ | 10 | 27 | |||
| 硫原子 | 16 | 32 | |||
| 11 | 11 | 23 |
三、填空题(2×10=20分)
8.离子化合物(如 )一般由 元素与 元素组成.形成离子化合物时, 原子失去电子,变成 离子; 原子得到电子,变为 离子.带相反电荷的离子相互作用形成 ,它的构成粒子为 .
9.共价化合物(如 )一般由 元素与 元素组成.共价化合物形成时,通过原子间 结合,形成 ,其构成粒子为 .
四、推断题(1×10=10分)
10.有核电荷数均小于20的A、B、C、D四种元素,A能形成氧化物AO,其中A元素的质量分数为60%,且A元素原子核内质子数等于中子数, B元素原子内无中子, C原子和D-都比B原子多17个电子,试回答:
(1)写出各元素的名称及元素符号:A B C D
(2)画出A、D-的粒子结构示意图,A D- .
(3)写出四种元素间能组成物质的化学式 .其中属于离子化合物的是 (写名称).属于共价化合物的是 (写名称)
【素质优化训练】
1.某粒子的结构示意图为:
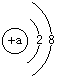
(1)该粒子有 个电子层,最外层有 电子;
(2)若该粒子带2个单位的负电荷,则a等于 ;
(3)若该粒子带3个单位的正电荷,则a等于 ;
(4)在(2)和(3)中所叙述的粒子构成化合物的化学式为 ,该化合物属于(共价,离子) 化合物.
2.不同的分子中,可能含有相同数目的电子.请写出五种化学性质不同,但每个分子均含有10个电子的物质的化学式 、 、 、 、 .
3.已知R原子最外层电子数为4,甲学生说A原子一定是金属元素的原子,乙学生说A原子一定是非金属元素的原子,丙学生说甲和乙说的都不对.请分析三位学生谁说的对?为什么?
【知识探究学习】
交流与讨论:解释下列原因:
(1)为什么氦气、氖气是单原子分子,氢气、氯气为双原子分子.
(2)为什么氯元素与钠元素化合时形成离子化合物,而氯元素与氢元素化合时形成的是共价化合物.

参考答案:
【同步达纲练习】
一、1.A 2.B 3.C 4.B 5.A 6.A
二、7.C 6、12;铝离子 13.14;S2- 18、16;钠原子 Na 12;8.NaCl,金属,非金属,金属元素,阳;非金属元素,阴,离子化合物,阴、阳离子 9.HCl,非金属、非金属,共用电子对,共价化合物,分子 10.(1)镁Mg 氢H 氩Ar 氯Cl;(2)略;(3)MgCl2、HCl、氯化镁、氯化氢
【素质优化训练】
1.(1)2,8;(2)8;(3)13;(4)Al2O3,离子
2.CH4、NH3、H2O、HF、Ne
3.丙说的对,因为最外层有4个电子的原子,可能是金属元素的原子,也可能是非金属元素的原子.
【知识探究学习】
解答:(1)氦气、氖气的原子已达到稳定结构,而氢气、氯气的原子的最外都需一个电子而达到稳定结构,两个原子各拿一个电子形成共用电子对,从而使每个原子都形成稳定结构.
(2)金属元素的原子一般容易失去电子,非金属元素的原子一般容易得到电子,氯原子与钠原子化合时,钠原子失电子,氯原子得电子,形成阴阳离子,相互作用形成离子化合物.氯原子与氢原子化合时,各拿出一个电子形成一个共用电子对,在共用电子对的作用下形成了共价化合物.
