初三化学综合模拟训练三
相对原子质量:H:1 C:12 O:16 Cu:64 S:32 Ba:137 Fe:56
K:39 Cl:35.5
一、选择题(每小题只有一个选项符合题意,共60分)
1.下列变化属于化学变化的是
A.用自来水制蒸馏水
B.在晾干的咸菜表面出现食盐晶体
C.石蜡熔化
D.白磷自燃
2.当前我国环境保护亟待解决的“白色污染”通常指的是
A.冶炼厂的白色烟尘
B.石灰窑的白色粉末
C.聚乙烯等塑料垃圾
D.白色建筑废料
3.在蔬菜生长过程中,常喷洒农药防治病虫害。据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上的农药的毒性降低。因此,买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间。浸泡蔬菜时可加入适量
A.白酒 B.白糖
C.食醋 D.纯碱
4.当液化石油气严重漏气后,应采取的措施是
A.点燃蜡烛,检查漏气部位
B.关闭门窗,防止空气进入室内
C.关闭贮气瓶开关,打开门窗
D.降温后使其析出部分晶体
5.我国城市空气污染物检测,暂时不包括
A.二氧化硫 B.氮氧化物
C.一氧化碳 D.悬浮颗粒
6.下列各项措施或操作,不会对环境造成污染或破坏的是
A.过量砍伐森林树木
B.把化工厂烟囱加高或迁往郊区
C.利用风能、太阳能发电
D.大力发展各种燃油机动车
7.CO中混有少量水蒸气和CO2,要得到纯净、干燥的CO,可将该混合气体依次通过
A.灼热的CuO、浓H2SO4
B.浓H2SO4、灼热的CuO
C.浓H2SO4、NaOH溶液
D.NaOH溶液、浓H2SO4
8.下列关于物质用途的叙述,易造成重大伤亡事故的是
A.活性炭可作冰箱除臭剂
B.熟石灰可用来粉刷墙
C.庆典活动可使用大量氢气球
D.钛合金可做轮船外壳
9.提纯含少量泥沙的粗盐,正确的操作顺序是
A.过滤、蒸发结晶、溶解
B.溶解、蒸发结晶、过滤
C.蒸发结晶、溶解、过滤
D.溶解、过滤、蒸发结晶
10.把少量的下列物质分别放入盛有足量水的烧杯中,充分搅拌,可以得到溶液的是
A.泥土 B.蔗糖
C.植物油 D.碳酸钙粉末
11.下列物质的名称与化学式不一致的是
A.酒精 C2H5OH B.醋酸 CH3COOH
C.胆矾 CuSO4·5H2O D.食盐 NaNO2
12.从100 g 15%的NaOH溶液中取出20 g,将剩余的溶液与原溶液进行比较没有发生变化的是
A.溶质质量 B.溶剂的质量
C.溶液的质量 D.溶质的质量分数
13.除去铜粉中混有的少量氧化铜,方法正确的是
A.在空气中加热
B.加入足量的水,充分搅拌后过滤
C.加入足量的铁粉,反应后过滤
D.加入足量的盐酸,充分反应后过滤
14.x、y两金属都能跟硝酸银溶液起反应,置换出银;x跟稀H2SO4不反应,y跟稀硫酸起反应生成氢气。由此判断x、y两金属可能依次是
A.Cu、Zn B.Fe、Zn
C.Cu、Hg D.Fe、Hg
15.溶质的质量分数为20%的某二价金属的硫酸盐溶液200 g,其中含硫元素8 g,此二价金属的相对原子质量为
A.24 B.56
C.64 D.65
16.下列各组中的物质,依次加入水中并不断搅拌,最终能形成无色溶液的是
A.FeCl3、NaOH、稀盐酸
B.AgNO3、NaCl、稀硝酸
C.MgSO4、NaNO3、石灰水
D.CaCl2、Na2CO3、稀盐酸
17.下列各组物质能在同一溶液中大量共存的是
A.Na2CO3、NaOH、CaCl2
B.CaCl2、NaCl、KNO3
C.NaOH、Na2SO4、H2SO4
D.AgNO3、FeCl3、CuSO4
18.某硫酸溶液中,加入BaCl2溶液直至不再产生沉淀为止,生成沉淀的质量等于原硫酸溶液质量的1/2,则原硫酸溶液中溶质质量分数为
A.21% B.23.8%
C.42.1% D.84.1%
19.下列没有元素化合价变化的是
A.用磷制造烟幕 B.撒布干冰产生云雾
C. KClO3与MnO2混合加热 D.电解水
20.几种物质溶于水,能电离出K+、Mg2+、Cl-、SO2-4四种离子,已知其中K+、Mg2+、Cl-三种离子的个数比依次为1∶2∶3,则SO2-4与K+的个数比是
A.1∶1 B.1∶2
C.1∶3 D.2∶3
21.用等质量的氢气、碳、一氧化碳三种还原剂分别还原足量的氧化铜,生成铜的质量比为
A.1∶6∶14 B.1∶2∶14
C.1∶1∶1 D.42∶14∶3
22.把下列四种金属各1 g分别投入到足量的稀H2SO4中,完全反应后溶液质量增加最多的金属是
A.Zn B.Fe
C.Mg D.Al
23.x、y、z三种物质,它们之间的转化关系为
![]() ,则x是
,则x是
A.Mg B.K2O
C.CaO D.Ca(OH)2
24.在CuSO4和ZnSO4的混合溶液中加入过量的铁粉,充分反应后过滤,滤液中存在的金属离子是
A.Cu2+、Zn2+ B.Zn2+、Fe2+
C.Cu2+、Fe3+ D.Cu2+、Fe2+
25.下列说法错误的是
A.生铁和钢都是铁的合金
B.生铁的含碳量比钢高
C.铁是地壳里含量最多的金属元素
D.钢较硬,机械性能好,可以锻轧和铸造
26.能解释古代铁制品保存至今很少的原因是
A.铁元素在地壳里含量较少
B.冶炼铁的原料少,且冶炼困难
C.铁易置换出其他金属
D.铁易锈蚀,且铁锈对铁制品无保护作用
27.在实验室里用氢气还原氧化铜的装置,能否用来做CO还原CuO的实验
A.能。因为都是气体和固体反应
B.能。因为两个反应都需要加热
C.不能。因为CO的密度比空气大
D.不能。因为CO有毒
28.某工厂排出的废水中含有Cu2+,其pH小于7,某校化学课外活动小组的四位同学,分别设计了除去Cu2+和酸性的方案,其中较合理的是
A.加氧化铜 B.加入硫酸钠
C.加入石灰石 D.加入生石灰
29.新买的铝锅用来烧开水时,凡是水浸到的地方都会变黑,说明水中溶解有
A.钾盐 B.钠盐
C.钙盐 D.铁盐
30.2001年华北地区多次发生扬沙和沙尘暴天气,造成这一现象的原因是
A.大气污染的结果
B.土壤污染的结果
C.植被遭到破坏的结果
D.火山爆发的结果
二、填空题(31~34题每空1分,35~37题每空2分,共26分)
31.目前世界上最重要的三大矿物燃料是______、______、______。人们正在利用和开发的新的能源有_________________________。
32.判断下列化学符号中数字“2”的含义,将其序号填在相应的横线上。
①Ca2+ ②NO2 ③2NO ④![]() O ⑤2PO3-4
O ⑤2PO3-4
(1)表示分子个数的是______;(2)表示一个离子所带电荷数的是______;(3)表示元素化合价的是______;(4)表示一个分子中所含原子个数的是______。
33.氢氧化钠俗称苛性钠,这是因为它具有强烈的______性;氢氧化钠必须密封保存,因为它能吸收空气中的水分,并能跟空气中的______起反应。
34.某种牙膏中含有抗牙腐蚀的药物,其化学式为Na2FPO3,已知F为-1价,其核电荷数为9。则该药物中磷的化合价为______,如果药物的相对分子质量为144,求氟原子核内有______个中子。
35.A、B两元素的相对原子质量之比为7∶2,在它们所形成的化合物中,A、B元素的质量比是21∶8,则用A、B表示的该化合物的化学式是_____________。
36.已知x、y、z三种金属,它们在溶液中能发生如下反应:
x+yCl2 x Cl2+y;z+xCl2 zCl2+x;x+2HCl x Cl2+H2↑
则这三种金属(包括氢)金属活动性由强到弱的顺序可能有_____________;_____________。
37.蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S)。硫化氢气体是一种大气污染物,它在空气中点燃、完全燃烧时,生成二氧化硫和水。把硫化氢气体通入浓硫酸中,发生的反应为:H2S+H2SO4(浓) SO2+X↓+2H2O
(1)上述内容中,属于硫化氢物理性质的是_____________。
(2)写出硫化氢在空气中完全燃烧的化学方程式_____________。
(3)硫化氢与浓硫酸反应时,生成物中X的化学式是___________________。
(4)若尾气中含有硫化氢,用浓硫酸来吸收行吗?为什么?________________。
三、实验题(17分)
38.某溶液中含有Na+、H+、Cl-、SO2-4,欲证明两种阴离子确实存在,选用的最佳方案是:先向溶液中滴加足量的______溶液至沉淀不再生成,再取上层清液滴加______溶液,又出现白色沉淀,则可得出结论。
39.由下列实验装置图回答问题:
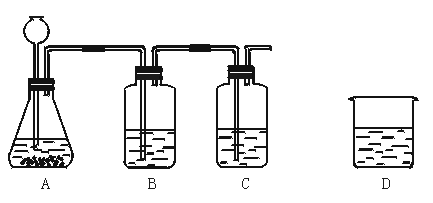
(1)若A中加入浓盐酸和锌粒制取氢气。为了验证制得的氢气中含有氯化氢,B中加入水后,还应滴入少量______;要制得干燥的氢气,C中应装入______。
(2)若向A中加入浓盐酸和大理石,制取的气体是______,检验该气体时,应将制取的气体通入盛有______的D中。
40.实验室通常用加热氯酸钾和二氧化锰的混合物的方法制取氧气。请根据所学知识回答下列问题:
(1)反应的化学方程式:___________________________。
(2)若用向上排气法收集氧气如何检验氧气已收集满了?
(3)反应前后,固体混合物中MnO2质量______,反应后MnO2的质量分数______。(填序号:A.不变、B.减小、C.增大)
(4)充分反应后的剩余物为______,属于______(填混合物或纯净物),用______法可分离得到二氧化锰。
四、计算题(第41题9分,42题8分,共17分)
41.27.6 g氯酸钾与2 g二氧化锰受热制取一定量的氧气后,使反应停止,测得剩余固体中含二氧化锰的质量分数为10%,求
(1)剩余固体的质量?
(2)制得氧气多少克?
(3)有多少克氯酸钾没有分解?
42.向6.8 g铁和氧化铁的混合物中通入CO,加热至完全反应,继续通CO直至冷却,称量为5.6 g,将这5.6 g固体与足量的稀盐酸反应制取氢气。计算:
(1)制得氢气的质量;
(2)混合物中氧化铁的质量分数。
综合模拟训练三
一、1.D 2.C 3.D 4.C 5.C 6.C 7.D 8.C 9.D 10.B 11.D 12.D 13.D 14.A 15.A 16.D 17.B 18.A 19.B 20.A 21.D 22.A 23.C 24.B 25.C 26.D 27.D 28.D 29.D 30.C
二、31.煤 石油 天然气 太阳能、风能、地热、潮汐、核能、氢能等
32.③ ① ④ ②
33.腐蚀 CO2
34.+5 10
35.A3B4
36.Z、X、Y、(H) Z、X、(H)、Y
37.(1)无色、有臭鸡蛋气味
(2)2H2S+3O2![]() 2SO2+2H2O
2SO2+2H2O
(3)S
(4)不行,因为生成物SO2污染空气
三、38.Ba(NO3)2 AgNO3
39.(1)AgNO3 浓H2SO4
(2)CO2 澄清石灰水
40.(1)2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(2)用带火星的木条放在集气瓶口,木条复燃则满。
(3)A C
(4)KCl、MnO2 混合物 过滤
四、41.(1)20 g (2)9.6 g (3)3.1 g
42.(1)0.2 g (2)58.8%