初中化学总复习
第一单元 初三基本概念和基本原理下
应试能力测试:
一、选择题(每小题只有一个选项符合题意。)
1.下列各组中的物质的变化都属于物理变化的是 ( )
A. 冰融化成水,二氧化碳制成干冰 B. 蜡烛熔化,蜡烛燃烧
C. 原子转化成离子,离子转化成原子 D. 火药爆炸,气球爆炸
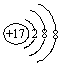
2.下列粒子的结构示意图或符号:① ![]() ,② Cu2+,③ OH-,④
,② Cu2+,③ OH-,④ ![]() ,⑤ Ne
,⑤ Ne
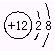 | |||
,⑥ ,⑦ Al,其中能表示离子的是 ( )
A. ①④⑤ B. ②③⑥ C. ②⑥⑦ D. ②④⑤
3.下列对于元素R及其含氧酸HmROn的下列说法中,正确的是 ( )
A. R一定是非金属元素
B. 在HmROn中R的化合价一定是+(2n-m)
C. HmROn一定能形成酸式盐
D. 在常温下纯净的HmROn一定呈液态
4.下列叙述中正确的是 ( )
A. 化合反应的反应物一定都是单质
B. 分解反应的生成物都是化合物
C. 复分解反应的生成物都是化合物
D. 有单质和化合物生成的反应一定是置换反应
5.有X、Y和Cu三种金属,将X和Y浸入稀硫酸中,Y溶解,X不溶解;将Cu浸入到X的硝酸盐溶液里,Cu表面有X析出,则三种金属的活动性由强到弱的顺序是 ( )
A. X、Y、Cu B. Y、X、Cu
C. X、Cu、Y D. Y、Cu、X
6.下列叙述中,正确的是 ( )
A. 相对原子质量是一个比值,它的国际单位制(SI)单位为1
B. 相对原子质量只是一个比值,它是没有单位的
C. 相对原子质量就是原子的质量
D. 碳的相对原子质量是12 g
7.某元素R原子的核电荷数为1~18之间,已知R2- 的核外有x个电子,则R原子的核内质子数及与钠化合时的化学式分别是 ( )
A. x、Na2R B. 2x、NaR C. ( x-2)、Na2R D. ( x+2)、Na2R
8.下列各组物质混合后,能形成溶液,溶液的pH大于7的是 ( )
A. 氯化物和水 B. 三氧化硫和水
C.生石灰和水 D. 氢氧化铜和水
9.在下列反应中既不属于化合反应或分解反应,也不属于置换反应或复分解反应的是
( )
A. CH4+2O2![]() CO2+2H2O
B. C+H2O
CO2+2H2O
B. C+H2O ![]() CO+H2
CO+H2
C. Cu2(OH)2CO3![]() 2CuO+CO2+H2O D. Ba(OH)2+CuSO4=BaSO4¯+Cu(OH)2¯
2CuO+CO2+H2O D. Ba(OH)2+CuSO4=BaSO4¯+Cu(OH)2¯
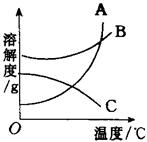
10.右图是A、B、C三种固体物质的溶解度曲线,当它们的溶液接近饱和时,若分别采用升高温度、蒸发溶剂、增加溶质的方法,均可使之变为饱和溶液的是 ( )
A. A溶液 B. B、C溶液
C. C溶液 D. A、B溶液
二、填空题
11.从A—N中选出适当的选项分别用字母代号填在下列横线上。
A. 熔点,B. 沸点,C. 酸性,D. 碱性,E. 颜色,F .密度,G. 溶解性,H. 腐蚀性,I. 吸水性,J. 氧化性,K. 可燃性,L. 还原性,M. 毒性,N. 挥发性。
① 氢气可作高能燃料,是因为它具有 ;② 使用浓硫酸、氢氧化钠时要特别小心,因为它们有很强的 ;③ 锌和浓硫酸不生成氢气而生成水,是因为浓硫酸有很强的 ;④ 氧气在燃烧反应中表现出 ;⑤ 酒精瓶的瓶塞要盖紧,是因为它有较强的 ;⑥ 由于固体NaCl和CaCO3的 不同,可用水鉴别;⑦ 液态空气中,各种物质的 不同,工业上用液态空气制氧气;⑧ 利用盐酸的 ,可清除铁器表面的锈;⑨ 煤气有 ,所以生煤炉时,要安装烟囱;⑩ 根据 不同,稀释浓硫酸时只能将其慢慢地加入水中。
12.把100 mL水和100 mL酒精混合在一起,结果总体积 (填“大于”、“小于”或“等于”)200 mL,这说明 ;放在衣柜中的樟脑丸,时间久了就不见了,这是发生了 变化,此变化说明① ;② 。
13.录象带用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3-xO3+x的化合物。已知氧元素为 -2价,钴(Co)和铁可能是+2价或+3价,且上述化合物中,每种元素只有一种化合价。则x值为 ,铁的化合价为 ,钴的 。
14.现有A、B、C三种金属,已知A能把C从其硝酸盐溶液中置换出来,B能与无色的X溶液反应产生氢气,A不能与X溶液反应,则三种金属的活动性由强到弱的顺序是
;若C为银,则A为 ;若向X溶液中加入几滴酚酞试液,则溶液显 色。
15.已知在沥青中有一系列组成有规律的化合物:C10H8、C16H10、C22H12……,从C10H8开始,这一系列化合物中的第25个物质的化学式为 。
16.某元素A的+3价离子结构示意图为 ,则n= 。B原子与A原子电子
层数相同,且最外层电子数比A原子的多4个,则A、B两种元素形成化合物的化学式为
(用A、B表示),其电离方程式为 。
17.某化工厂排放的无色废水经测定pH=3,为治理废水,需将此废水pH调节至7.5~8,为达到此目的,并采用经济可行的的方法,需在此废水中加入 (填序号:① Fe,② NaOH,③ 生石灰)。
三、计算题
18.已知某纯净物4.6 g完全燃烧需消耗9.6 g氧气,生成8.8 g二氧化碳和5.4 g水,由此判断该纯净物的组成元素及该物质分子中各元素原子的个数比。
四、创新题
19.下表列出了1 cm3活性炭吸附的常见气体的体积。试分析活性炭吸附气体,跟气体的 有关,具有 性质的气体,易于被活性炭吸附。
| H2 | NH3 | CO2 | O2 | N2 | Cl2 | |
| 气体沸点 / ℃ | -252 | -33 | -78 | -183 | -196 | -34 |
| 吸附气体 / mL | 4.5 | 178 | 97 | 35 | 11 | 494 |
链接中考:
一、选择题(每小题只有一个选项符合题意。)
1.(01安徽)下列变化中,属于化学变化的是 ( )
A.碳酸钠晶体在干燥空气中失去结晶水
B.放在衣服里的樟脑丸逐渐变小
C.酒精挥发
D.木炭放入盛有红棕色NO2的气瓶中,瓶中红棕色褪去
2.(02四川)下列说法中,错误的是 ( )
A.H2是保持氢气化学性质的最小粒子
B.一种元素可以组成多种单质
C.氢氧化钙和盐酸的反应,既是中和反应,又是复分解反应
D.净化除去粉尘后的空气是纯净物
3.(02乌鲁木齐)下列叙述中,正确的是 ( )
A.浓溶液一定是饱和溶液
B.可燃物只要与氧气接触便可燃烧
C.溶液在加水稀释前后溶质的质量不变
D.催化剂在化学反应中只能加快反应速率
4.(01上海)1999年诺贝尔化学奖获得者艾哈迈德·泽维尔(Ahmed H.Zewail),开创了“飞秒(10-15秒)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是 ( )
A.化学变化中反应物分子的分解
B.反应中原子的运动
C.化学变化中生成物分子的形成
D.原子核的内部结构
5.(00福州) 将15.5g KClO3和MnO2的混合物加热,待完全反应后得到10.7g固体物质,根据质量上守恒定律,生成O2的质量是 ( )
A.6.9 g B.6.1 g C.4.8 g D.9.6 g
二、填空题
6.(02黄冈)写出下列物质的化学式或化学符号:
(1)2个铝原子 ;
(2)3个氧分子 ;
(3)4个硫酸根离子 ;
(4)碳酸钠晶体 ;
(5)尿素 ;
(6)氯酸钾中氯的化合价为+5价 。
7.(00内蒙古)有A、B、C、D、E五种元素,A的单质是密度最小的气体,B的次外层电子数占电子总数的1/4;C的阳离子C+ 比B原子多2个电子;D和C具有相同的电子层数;D-的离子结构与氩原子结构相同;E和B具有相同的最外层电子数,但比B多一层。试回答:
(1)写出五种元素符号:A ,B ,
C D ,E 。
(2)写出D-的离子结构示意图 。
答 案
应试能力测试:
一、1. A 2. B 3. B 4. C 5. D 6. A 7. C 8. C 9. A 10. C
二、 11. ① K ② H ③ J ④ J ⑤ N ⑥ G ⑦ B ⑧ C ⑨ M ⑩ F
12. 小于;分子间有间隙;物理;分子是运动的;由分子构成的物质在发生物理变化时,分子本身没有变化
13. 1;+3;+2
14. B>A>C;Cu或Hg;无
15. C154H56
16. 13;AB3;AB3=A3++3B-
17. ③
三、18. 解:一种物质燃烧只生成水和二氧化碳,则该物质肯定含有碳和氢元素。是否含氧则可根据质量守恒定律由下法确定:
8.8
g二氧化碳中含氧元素的质量为:8.8
g×![]() =6.4 g,含碳元素的质量为:8.8 g-6.4 g=2.4 g
=6.4 g,含碳元素的质量为:8.8 g-6.4 g=2.4 g
5.4
g水中含氧元素的质量为:5.4
g×![]() =4.8 g,含氢元素的质量为:5.4 g-4.8 g=0.6 g
=4.8 g,含氢元素的质量为:5.4 g-4.8 g=0.6 g
4.6 g某纯净物中含氧的质量为:4.8 g+6.4 g-9.6 g=1.6 g
(或:4.6 g-2.4 g-0.6 g =1.6 g )
某纯净物中C︰H︰O=![]() ︰
︰![]() ︰
︰![]() =2︰6︰1
=2︰6︰1
答:该物质由C、H、O三种元素组成,其分子中C、H、O原子个数比为2︰6︰1
四、 19. 相对分子质量和沸点;相对分子质量越大,沸点越高
链接中考:
一、1.A 2.D 3.C 4.D 5.C
二、6.(1)2 Al (2)3O2 (3)![]() (4)Na2CO3·10H2O (5)CO(NH2)2
(4)Na2CO3·10H2O (5)CO(NH2)2 ![]()
7.(1)H、O、Na、Cl、S (2)