初三年级化学第一学期期末练习
学校 班级 姓名 成绩
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 K:39 Zn:65
一、选择题(本题共15道小题,每小题2分,共30分;在下列各题的4个选项中,只有1个选项符合题目要求)
1. 下列物质属于溶液的是 ( )
A. 冰水 B. 无水酒精 C. 泥浆 D. 食盐水
2. 下列变化属于化学变化的是 ( )
A. 冬天花生油凝固
B. 海水晒盐
C. 夏天敞口的啤酒久置变酸
D. 汽车轮胎爆炸
3. 下列实验现象中正确的是 ( )
A. 木炭在氧气中燃烧,有无色刺激性气味气体生成
B. 蜡烛在氧气中燃烧,发出白光,反应后瓶壁上出现液滴,加入澄清石灰水后变浑浊
C. 红磷在氧气中剧烈燃烧,有黄色火焰,生成大量白色气体
D. 铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色熔融物溅落瓶底
4. 下列物质中,前者属于混合物,后者属于纯净物的是 ( )
A. 矿泉水、硫酸铜 B. 碘酒、空气
C. 金属镁、糖水 D. 水银、海水
5. 在化学反应中一定没有发生变化的是( )
A. 物质的种类 B. 分子的种类
C. 原子的种类 D. 分子的个数
6. 下列实验操作中,不正确的是 ( )
A. 给试管里的液体加热,液体体积不超过试管容积的1/3
B. 用胶头滴管滴加液体时,滴管下端紧贴试管内壁
C. 将盛有液体的蒸发皿,直接放在铁架台的铁圈上加热
D. 停止加热时,用灯帽盖灭酒精灯
7. 氢气可以用来冶炼钨、钼等金属,这是因为氢气 ( )
A. 具有可燃性 B. 具有还原性
C. 密度小于空气 D. 难溶于水
8. 下列含氮物质中,氮元素的化合价由高到低顺序排列的一组是 ( )
A. NH3、N2、HNO3
B. HNO3、N2、NH3
C. N2、HNO3、NH3
D. HNO3、NH3、N2
9. 某气体既能用排水法收集,又能用向上排空气法收集,由此判断该气体具备的性质是( )
A. 易溶于水、密度比空气小
B. 易溶于水、密度比空气大
C. 难溶于水、密度比空气小
D. 难溶于水、密度比空气大
10. 黑火药是我国四大发明之一,距今已有一千多年的历史,黑火药爆炸的原理可用下式
表示:![]() ,根据质量受恒定律可推出X的化学式为( )
,根据质量受恒定律可推出X的化学式为( )
A. CO2 B. CO C. NO D. SO2
11. 使一瓶接近饱和的硝酸钾溶液变成饱和溶液,不可以选用的方法是 ( )
A. 蒸发溶剂 B. 升温
C. 降温 D. 加入硝酸钾晶体
12. 用固体氢氧化钠配制50g 20%的氢氧化钠溶液时,其操作顺序正确的是 ( )
A. 溶解、天平称量、量筒量取、计算
B. 量筒量取、天平称量、计算、溶解
C. 天平称量、量筒量取、计算、溶解
D. 计算、天平称量、量筒量取、溶解
13. 运送“神州5号”载人飞船的是长征二号F捆绑式大推力运载火箭,升空时的主要燃料之一是偏二甲肼(分子式为C2H8N2)。下列有关偏二甲肼组成的叙述,正确的是 ( )
A. 由2个碳原子、4个氢气分子、1个氮气分子构成
B. 由碳、氢、氮三个元素组成
C. 碳、氢、氮的原子个数比为6∶2∶7
D. 碳、氢、氮元素的质量比为6∶2∶7
14. 已知在反应A+2B→C+2D中,参加反应的A和B的质量比为1∶5。当2g A和足量B完全反应后,生成4g的D,则反应生成的C为 ( )
A. 2g B. 4g C. 6g D. 8g
15. 经测定,某含有C、O两种元素的混合气体中,C元素的质量分数为22%,则该混合物中 ( )
A. 一定有CO2 B. 一定有CO2、CO
C. 一定有O2 D. 一定有CO2、CO、O2
二、填空题(本题共3道小题,共22分)
16. (6分)
(1)碳元素的原子结构示意图为![]() ,则碳元素原子的核电荷数为__________,其化学性质与下列选项中哪种元素原子的化学性质相似__________(填序号);
,则碳元素原子的核电荷数为__________,其化学性质与下列选项中哪种元素原子的化学性质相似__________(填序号);
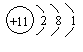
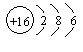
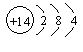
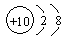
(A) (B) (C) (D)
(2)由B选项元素组成的单质与氧气发生反应时,其现象除了有剧烈燃烧,放出大量的热以外,还有__________,该反应的化学方程式为____________,其反应类型为___________;
(3)由氧元素组成的单质除了氧气以外,还有臭氧(O3),臭氧是淡蓝色的气体,有一种鱼腥臭味,性质不稳定,在常温下分解较慢,当有二氧化锰存在时,会促使臭氧分解加快,生成一种无色无味气体,则臭氧分解的化学方程式为_______________。
17. (10分)
(1)碘酒溶液中溶质是____________,溶剂是_________;
(2)下列溶液中一定是饱和溶液的是____________(填序号);
A. 无色透明溶液
B. 含有未溶氯化钠固体的氯化钠溶液
C. 紫红色透明溶液
D. 将硝酸钾溶液降温析晶后所得溶液
(3)将甲、乙两固体溶解于水中,其溶解度曲线如图所示,
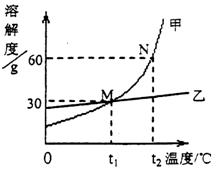
① N点所表示的含义是____________;
② t2℃时,甲物质的饱和溶液的质量分数为___________;
③ t1℃时,甲物质饱和溶液的质量分数__________(填“>”、“<”或“=”)乙物质饱和溶液的质量分数;
④ 若甲和乙的混合溶液中含有少量乙物质,则提取甲物质的方法是_______________;
(4)用10g 98%的硫酸溶液(体积约为5mL)加入到90g水(体积为90mL)中,则所得硫酸溶液的质量分数为____________;按上述要求配制好溶液后,实际测得溶液的体积小于95mL,配制前后溶液体积并不守恒,其原因是__________。
18. (6分)
(1)化学式接龙,要求:
①所填写的物质中至少含有前一种物质中的某一种元素;
②所填写的物质符合方框内要求的物质类别;
③所填写的物质不要重复。
示例如下:
|
|
![]()
![]() Mg
Mg
请你仿照示例填写方框内物质的化学式:
![]()
![]()
|
|
|
|
![]() H2
H2
(2)分别以氧化物①和单质④为线索,书写含有该物质的化学反应方程式,该物质在方程式中既可以是反应物,又可以是生成物,所书写的化学方程式不要重复。
含氧化物①的化学方程式为__________;含单质④的化学方程式为___________。
三、实验题(本题共2道小题,共19分)
19. (10分)某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去)。请填写下列空白:
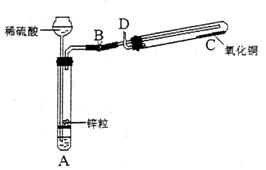
(1)实验时,打开B处止水夹,在试管A中,除了液面上升以外,用眼睛还可以观察到的现象是___________,过一段时间后,用手触摸试管A的外壁可以感觉到的现象是_________,试管A中发生反应的化学方程式为____________,其反应类型为___________;
(2)在做氢气还原氧化铜实验之前,必须在D出口处__________,然后在__________处点燃酒精灯加热;实验过程中,在试管C中可以观察到的现象是____________;发生反应的化学方程式为____________;实验结束时,____________关闭B处止水夹,___________停止加热(填“先”或“后”);
(3)实验过程中,该同学若想证明氢气具有可燃性,其实验操作是______________。
 20. (9分)粗食盐中混有不溶于水的泥沙,通过下述实验除去泥沙等杂质,使粗食盐得到提纯。
20. (9分)粗食盐中混有不溶于水的泥沙,通过下述实验除去泥沙等杂质,使粗食盐得到提纯。
(1)在上述仪器中,可用于粗盐提纯实验的有___________(填写仪器名称);
(2)按要求填写粗盐提纯实验的主要操作步骤及其相关内容:
|
↓
| |
↓
| |
(3)某同学在同等实验条件下,所得产品的产量明显比其他同学少,请你帮他分析可能的原因(写出两条即可)①__________;②____________。
四、计算题(本题共2道小题,共9分)
21. (4分)实验室里用加热分解氯酸钾的方法制取氧气,若反应生成了1.92g氧气,则反应物中发生分解的氯酸钾有多少克?写出反应的化学方程式,并依据化学方程式进行计算。
22. (5分)用98.0g的稀硫酸溶液与过量的20.0g锌粒充分反应制取氢气,反应后称量剩余物的质量为117.8g。试计算:
(1)产生氢气多少克?在标准状况下对应氢气的体积约为多少升?(已知标准状况下氢气的密度约为0.09g/L)
(2)反应后所得溶液中溶质的质量分数?
 |
『答案』
一、选择题(本题共15道小题,每小题2分,共30分)
1. D 2. C 3. B 4. A 5. C
6. B 7. B 8. B 9. D 10. A
11. B 12. D 13. D 14. D 15. C
二、填空题(本题共3道小题,共22分)
16. (每空1分,共6分)
(1)6 C
(2)明亮的蓝紫色火焰,有无色刺激性气味的气体生成
![]() 化合反应
化合反应
(3)![]() (完全正确才给分,否则不得分)
(完全正确才给分,否则不得分)
17. (10分)
(1)碘 酒精(或乙醇) (每空1分,共2分)
(2)BD (每选项1分,共2分)
(3)①t2℃时,60g甲物质溶解在100g水里达到饱和状态(含4个要点,答案合理均给分,但溶剂必须指明是水,若只答溶剂,则不给分)
②37.5% ③=④降温结晶(或结晶,或冷却热饱和溶液)(每空1分,共4分)
(4)9.8% 分子之间有空隙 (每空1分,共2分)
18. (每空1分,共6分)答案合理均给分,答案示例:
|
|
|
|
![]() H2
H2
(2)含氧化物①的化学方程式
![]()
含单质④的化学方程式
![]()
三、实验题(本题共2道小题,共19分)
19. (10分)
(1)有气泡冒出 发热 Zn+H2SO4→ZnSO4+H2↑ 置换反应(每空1分,共4分)
(2)检验氢气纯度 C 黑色氧化铜变为红色,有无色液体生成
![]() 后、先
后、先
(3)点燃出口D处的氢气
(说明:“后、先”为一组,该组共1分,该组内错一空即不得分,其余每空1分,共6分)
20. (9分)
(1)酒精灯、漏斗、烧杯、蒸发皿(错1个得1分,错3个不得分,共2分)
(2)
|
① 将固体研碎、用玻璃棒搅拌(或加热)
|
② 引流
|
③ (每空1分,共5分)
(3)(答案合理均给分)示例:
①药品未完全溶解就开始过滤 ②蒸发时有溅出 (每空1分,共2分)
四、计算题(本题共2道小题,共9分)
21. (4分)
解:设发生分解的氯酸钾的质量为x
![]()
(1分)
245 96
x 1.92g (1分)
![]()
解得:x = 4.9g (1分)
答:发生分解的氯酸钾的质量为4.9g。 (解、设、答1分)
22. (5分)
解:(1)产生氢气的质量为98.0g+20.0g-117.8g=0.2g (1分)
则标况下氢气的体积为
![]() (1分)
(1分)
![]() (2)设生成硫酸锌的质量为x,参加反应的锌的质量为y
(2)设生成硫酸锌的质量为x,参加反应的锌的质量为y
65 161 2
y x 0.2g
![]()
![]()
解得:y = 6.5g x = 16.1g (2分)
硫酸锌的质量分数为![]() (1分)
(1分)
答:(1)产生氢气0.2g,在标况下体积为2.2L;
(2)反应后所得溶液的溶质的质量分数15.4% 。