初三年级化学模拟考试题(一)
班级_______姓名________得分________
请将选择题答案的序号填写在下列表格内:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|
|
|
|
|
|
|
|
|
|
|
|
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
|
|
|
|
|
|
|
|
|
|
|
|
原子量:
H:1 N:14 O:16 Na:23 Al:27 Cl:35.5 K:39 Ca:40
Fe:56 Cu:64 Ag:108
一. 选择题(每小题只有1个选项符合题意)
1. 下列变化中,没有发生化学变化的是:
A.向无色酚酞试液中通入二氧化碳,液体变为红色
B.无色氧气降温至-183℃变为淡蓝色固体
C.白色硫酸铜粉末遇水变蓝色
D.蓝色氢氧化铜灼热后变为黑色粉末
2. 下列物质属于纯净物,但不属于化合物的是:
A.水蒸气 B.水煤气 C.天然气 D.水银蒸气
3.下列说法中正确的是:
A.在一定温度下,某物质饱和溶液的溶质质量分数一定比它的不饱和溶液的质量分数大
B.燃烧一定要有氧气参加
C.在离子化合物中,某元素的化合价数值就是该元素原子得失电子的数目
D.氯化钠溶液能导电是因为氯化钠在电流的作用下,能离解成自由移动的Na+和Cl-
4.厄尔尼诺现象产生的原因之一是大气中二氧化碳剧增,为减缓此现象,最理想的燃料是:
A.优质煤 B.天然气 C.酒精 D.氢气
5.人的胃液中胃酸过多时,可服用适量的某些物质与胃酸反应,但不可服用:
A.含Al(OH)3的药物胃舒平 B.少量NaHCO3
C.含CaCO3的药物钙片 D.CaO固体
6.下列化学肥料属于复合肥料的是:
A.CO(NH2)2 B.Ca(H2PO4)2 C.KNO3 D.NH4NO3
7.区别CO和H2可采用的方法是:
A.点燃后观察火焰的颜色 B.通入水中
C.将燃烧产物通入澄清石灰水 D.通入灼热的氧化铜
8.下列归纳总结正确的是:
A.NaOH溶液能与一切非金属氧化物反应
B.酸能跟所有的盐起反应
C.活泼金属都可与酸反应制得H2
D.置换反应不一定要在溶液中发生
9.酸溶液能使紫色石蕊试液变红色,这是因为酸液里含有:
A.氢原子 B.氢分子 C.氢离子 D.酸根离子
10.在pH=1的溶液中,下列各组物质可能大量共存的是:
A.NaCl和NaOH B.Na2CO3和NaNO3 C.CaCO3和CaO D.KCl和KNO3
11.下列物质或溶液中存在自由移动的氯离子的是:
A.氯酸钾溶液 B.盐酸 C.氯气 D.氯化钠晶体
12.欲将含有硫酸的硫酸镁溶液转变为中性溶液,在没有指示剂的条件下,可选用:
A.Mg或MgCO3 B.NaOH C.Ba(OH) 2 D.BaCl2
13.向AgNO3、Cu(NO3) 2和Mg(NO3) 2的混合溶液中加入过量的铁粉,充分反应后溶液中含有的金属离子是:
A.Ag+、Cu2+、Mg2+、Fe2+ B.Cu2+、Mg2+、Fe2+
C.Mg2+、Fe2+ D.Cu2+、Fe2+
14.向足量稀硫酸中加入适量锌粉,下列图像能正确表示该过程变化情况的是:
 |
① ② ③ ④
A.①② B.②④ C.①③ D.②③
15.下列实验操作的先后顺序不正确的是:
A.制取气体时,先检查装置的气密性,后装入药品
B.制取氧气完毕时,先熄灭酒精灯,后把导气管撤出水槽
C.用氢气还原氧化铜时应先通一会H2,后加热
D.稀释浓H2SO4时,先将量好的水倒入烧杯中,再沿器壁慢慢注入浓H2SO4,并不断搅拌
16.把m克20%的氯化钠溶液,制成40%的氯化钠溶液,可采用的方法是:
A.蒸发掉m/2克溶剂 B.蒸发掉原溶剂的一半
C.加入m/3克溶质 D.降温析出m/5克晶体
17.配制一定浓度的稀盐酸,量筒放平,量取浓盐酸时视线仰视,量取水时视线俯视,则配得溶液的实际浓度将:
A.偏高 B.偏低 C.相等 D.无法判断
18.下列物质20克溶于80克水中后,充分搅拌,所得溶液中溶质的质量分数为20%的是:
A.Na2O B.Ca(OH)2 C.NaCl D.CuSO4·5H2O
19.NaNO3溶液中混有AgNO3、Ba(NO3)2、Cu(NO3)2,现要依次使Ag+、Ba2+、Cu2+逐一转化为沉淀并分离出来,可使用的试剂有Na2SO4、NaOH、NaCl溶液,试剂加入的顺序为:
A.NaCl、NaOH、Na2SO4 B.NaOH、Na2SO4、NaCl
C.Na2SO4、NaCl、NaOH D.NaOH、NaCl、Na2SO4
20.完全中和某一强酸溶液,需用10克溶质的质量分数为5.6%的KOH溶液。如果改用10克溶质质量分数为5.6%的NaOH溶液,反应后,溶液的pH值:
A.大于7 B.小于7 C.等于7 D.无法判断
21.由氧化镁和另一种金属氧化物组成的混合物4 g,经测定其中含氧元素1.8 g,则另一种氧化物是:
A.CuO B.CaO C.Al2O3 D.Fe2O3
22.黑火药是我国古代四大发明之一,把木炭粉、硫黄粉和硝酸钾按一定比例混合,可以制得黑火药。点燃时发生如下反应:2KNO3+S+3C![]() K2S+3CO2↑+X,其中X的化学式为:
K2S+3CO2↑+X,其中X的化学式为:
A.N2 B.NO2 C.SO 2 D.N2O3
二. 填空题(共24分)
23.保持水的化学性质的最小粒子是 ,水通电发生化学变化中的最小粒子是 和 ,该实验证明水是由 和 组成。并且证明分子和原子的本质区别是 。
24.二氧化碳能灭火的原因是:
①
②
③ 。
水也能用于灭火的原因是:
①
② 。
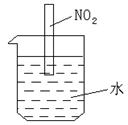 25.NO和NO2具有下列不同的性质:①通常状况下,NO是无色气体,微溶于水;NO2是棕色气体,易溶于水。②3NO2+H2O=2HNO3+NO,如图将一支充满NO2棕色气体的试管倒立在燃杯中(水中已预先加入数滴石蕊试液)。
25.NO和NO2具有下列不同的性质:①通常状况下,NO是无色气体,微溶于水;NO2是棕色气体,易溶于水。②3NO2+H2O=2HNO3+NO,如图将一支充满NO2棕色气体的试管倒立在燃杯中(水中已预先加入数滴石蕊试液)。
试分别描述试管内可能出现的实验现象:
⑴ ;
⑵ ;
⑶ ;
⑷ .
26.剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间,休息放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。此反应的化学方程式为 。
27.市售的黑底橡胶运动鞋,其鞋底具有良好的耐磨性能。这是因为在橡胶中加入了一种耐磨的填料,这种填料是 。
28.用废铜屑制取硫酸铜,有人拟定了以下两个实验方案:
A: 铜屑![]() 硫酸铜[Cu+2H2SO4(浓)
硫酸铜[Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑]
CuSO4+2H2O+SO2↑]
B: 铜屑![]() 氧化铜
氧化铜![]() 硫酸铜
硫酸铜
你认为比较合理的是 方案,
理由是 ______ 。
29.能将Na2CO3、Ba(OH) 2、BaCO3、Mg(OH) 2四种白色固体一次区别开的试剂是 。
30.某工业酸呈淡黄色,经测定其中含有H+、Fe3+、Cl-,则该盐酸中所含杂质的化学式 。若溶液中H+与Cl-的个数比为51∶60,则Fe3+与Cl-的个数比为 。
31.把一定质量的BaCl2和NaCl的混合物投入适量稀硫酸中,使其恰好完全反应,若生成沉淀的质量等于原混合物的质量,则原混合物中氯化钠的质量分数为 。
三. 推断题(共9分)
32.某气体可能是CO、CO2、H2O、H2的混合物,将其依次进行以下操作(假定每次处理均完全进行):
⑴通过浓硫酸,气体体积变小。
⑵通过灼热的氧化铜,黑色粉末变红。
⑶通过白色硫酸铜粉末,粉末变蓝色。
⑷通过紫色石蕊试液,试液变红色。
推断原混合气体中,一定含有 ,可能含有 或 ,为了确定这两种气体的存在情况,可在步骤 前面连接一个 装置。
33.由三种可溶性正盐组成的固体混合物,其中两种钠盐,按下列步骤实验:
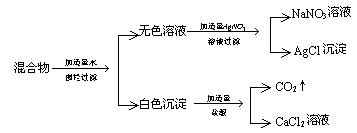
根据上述实验事实,可以判断固体混合物中一定含有 ,另外两种盐可能是(写化学式)① 和 ,② 和 ,③ 和 。
四. 实验题(共17分)
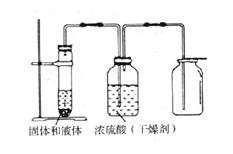 34.根据下图装置回答:
34.根据下图装置回答:
⑴实验室可用该装置制取干燥的 气体,所用的药品是 。若在上述实验中气体无法收集满,请说出可能的一种原因: 。
⑵若只改变收集方法,还可以制取干燥的 气体。
⑶把发生装置改装后,可用来制取干燥的氧气,但必须添加的一种仪器是 ,写出实验室制取氧气的化学方程式:
① ,② 。
35.用部分变质的锌与盐酸反应制得H2中混有CO2、HCl、水蒸气等杂质,通过如下装置证明并除去其中含有的杂质得到纯净干燥的H2还原Fe2O3,去测定水的组成。(假设每步的吸收均完全)
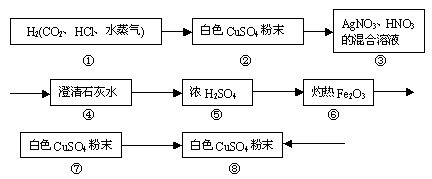 |
|
⑴指出②、③、④三处现象:
⑵指出③、⑥的作用:③ ;⑥ 。
⑶⑧处固体也部分变质的原因是 。由此得到装置⑧的作用是 。有关反应方程式为 。
⑷若⑥处固体药品反应前质量为a克,反应后为b克;⑦处固体反应前质量为c克,,反应后为d克,则参加反应的氢气质量为 ,水中氢氧元素质量比为 。
五. 计算题(6分)
36.现有NaNO3和NaCl的混合物10克,完全溶于水配成30克溶液,然后向其中滴加AgNO3溶液至不再产生沉淀时,共加入AgNO3溶液10克,将产生的沉淀过滤、干燥,称得质量为2.87克。求:⑴原混合物中NaNO3的质量分数;⑵所得滤液中溶质的质量分数。