初中化学总复习
第四单元 初三化学实验下
应试能力测试:
一、选择题(每小题只有一个选项符合题意。)
1.下列描述中,化学反应与实验现象不相符的是 ( )
A. 硫在空气里燃烧发出微弱的浅蓝色火焰
B. 木炭在氧气里燃烧发出明亮的白色火焰
C. 红磷在氧气中燃烧有大量白烟生成
D. 细铁丝在氧气中燃烧,火星四射,生成了一种叫四氧化三铁的黑色固体
2.下列化学实验基本操作中,正确的是 ( )
A. 用手拿试管,给试管里的物质加热。
B. 用滴管滴加液体时,滴管下端紧贴试管内壁。
C. 给试管里的液体加热时,液体体积不超过试管容积的三分之一。
D. 不慎将酸洒在皮肤上,应立即用氢氧化钠溶液中和。
3.某学生的实验报告中有如下数据:
① 用托盘天平称取工业用碳酸钠样品10.62 g
② 用量筒量取40.8 mL盐酸;
③ 用pH试纸测得盐酸的pH为1.53(与标准比色卡对照);
④ 工业用碳酸钠晶体的样品中,结晶水含量为56.64%。
以上数据合理的是 ( )
A. ①③ B. ②④ C. ①④ D. ②③
4.不用其它试剂,用最简单的方法鉴别下列五种物质的溶液:① NaOH,② MgSO4,③ FeCl3,④ Ba(NO3)2,⑤ KCl,则正确的鉴定顺序是 ( )
A. ②④③①⑤ B.③①②④⑤ C. ①③②④⑤ D. ③②④①⑤
5.某学生用量筒量取液体,量筒放平稳且面对刻度线,初次视线与量筒内液体的凹液面最低处保持水平,读数为18 mL;取出部分液体后,俯视凹液面最低处,读数为12 mL。则该学生实际倒出的液体体积是 ( )
A. 小于6 mL B. 等于6 mL
C. 大于6 mL D. 可能大于6 mL也可能小于6 mL
6.区别氧化汞、氯酸钾、高锰酸钾、碱式碳酸铜、硫等5种试剂最好选用 ( )
A. 观察法 B. 加热法 C. 溶解法 D. 称量法
7.实验室制取氧气大致可分为下列步骤:a. 点燃酒精灯;b. 检验装置的气密性;c.将氯酸钾和二氧化锰的混合物装人试管,用带导管的塞子塞紧试管,并把它固定在铁架台上;d. 用排水法收集氧气;e. 熄灭酒精灯;f. 将导管从水槽中取出。正确的操作顺序是 ( )
A. b c a d e f B. c b a d e f
C. b c a d f e D. c b a d f e
8.某校实验室只有烧碱、稀盐酸、铁片、氧化铜、大理石和水,从缺乏试剂的角度分析,下列实验无法进行的是 ( )
A. 用稀盐酸中和一定量的氢氧化钠溶液 B. 制取氢气
C. 制碳酸钠 D. 制氢氧化铜
9.气体M由H2、CO、CO2、HCl四种气体中的几种混合而成,将M依次通过:① NaOH溶液,② 灼热的CuO,③ 浓硫酸,每步反应中气体均完全反应,最后还有气体导出,则M中一定含有的气体是 ( )
A. H2 B. CO C. CO2 D. HCl
10.用托盘天平称量8.5 g氯化钠固体,其做法是:将砝码放在左盘,氯化钠固体放在右盘,并且取用8 g砝码,同时将游码移动0.5 g。问:这样做其结果实际称得氯化钠固体的质量为 ( )
A. 8 g B. 8.5 g C. 7.5 g D. 5 g
二、填空题
11.实验室常用氢气还原某些金属氧化物的方法,测定其中金属的含量。若用锌与稀硫酸制取氢气,需要依次通过甲盛有 和乙盛有 的洗气瓶,除去
和 ,才能进行定量实验测定。若无乙装置,测定结果可能会(填“偏高”或“偏低”) 。
12.为确定氯化氢气体中是否混有少量的二氧化碳、一氧化碳和氢气,设计如下实验流程(即混合气体依次通过入A、B、C、D、E各处中的试剂)。

(1) 根据上述实验,请写出A、C两处试剂的变化情况:
A ;C 。
(2) 要确认氯化氢气体混有二氧化碳、一氧化碳和氢气,以上的实验流程需修改成:
混合气体通过 处之前,应先通过碱液; 处中的试剂应与 处的试剂互换。
13.某同学用酚酞试液和浓氨水做“氨分子的扩散”实验,结果发现试管内滤纸上没有颜色,两试管口所塞的脱脂棉却变成了红色。导致这种现象产生的错误操作可能是
。这一实验还说明,所用两种试剂中 具有挥发性。
14.欲测定NaCl、BaCl2固体混合物中NaCl的质量分数,除科学设计实验操作程序外,你认为称取样品溶于水后应加入的试剂是 。依据测定的目的,使用这种试剂的理由是:① ,② 。
三、实验题
15. 用锌粒跟盐酸反应制取氢气(假设氢气中混有少量氯化氢气体和水蒸气),现用此氢气和下图所示的四种装置,按实验要求设计一个连续实验。
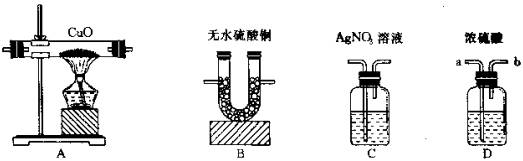
实验要求:① 验证此氢气混有氯化氢和水蒸气,② 除去氯化氢,③ 验证已除尽氯化氢,④ 用纯净的氢气还原氧化铜并进行称量以测定水的组成。试回答下列问题:
(1) 写出正确连接顺序的装置序号(可重复选用):不纯氢气 ® 。
(2) 若选用装置D,则气体应由 口进,由 口出(填接口字母)。
(3) 装置B的作用是 。
(4) 装置C的作用是 。
四、计算题
16.某碱ROH,其中R元素的质量分数为57.5%,对该碱的水溶液200 g进行中和实验,先在其中加几滴酚酞试液,当逐滴加入73 g质量分数为20%的盐酸时,溶液刚好呈无色。试回答:
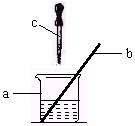
(1) 如图所示几种仪器的名称是:a ,b ,c 。
(2) ROH的水溶液滴加酚酞试液呈 色,实验中加入酚酞试液的作用是
。
(3) 计算200 g ROH的水溶液中ROH的质量分数。
五、创新题
17.某有机物在氧气中充分燃烧后,产物只有二氧化碳和水,甲、乙两组同学分别用A、B两种方法测定它的组成(如下图)。请你分析;选用的实验装置是 (填“甲”或“乙”),推测出该有机物是由 元素组成,各元素的质量比为 (假设实验过程中气体均全部被吸收

| 燃烧有机物的质量 | 实验装置 | 实验(1)~(4)装置质量 | ||
| 实验前 | 实验后 | |||
| 甲组 | 3.2 g | 甲 | (1) 150 g | (1) 154.6g |
| (2) 150 g | (2)153.4 g | |||
| 乙组 | 3.2 g | 乙 | (3) 150 g | (3) 153.6 g |
| (4) 150 g | (4) 154.4 g | |||
链接中考:
一、选择题(每小题只有一个选项符合题意。)
1.(02黄冈)下列有关实验操作的叙述中。正确的是 ( )
A.实验室制取氢气时,用向上排空气法来收集氢气
B.实验室制取氧气,停止加热时,应先熄灭酒精灯,然后再把导管移出水面
C.做氢气的还原性实验时,当刚向盛有氧化铜的试管通入氢气时,应立即给试管加热
D.倾倒液体进行过滤时,应使液体沿着玻璃棒流下,且液面要低于滤纸的边缘
2.(02北京东城)下列实验室制取气体的方法中,可行的是 ( )
A.燃烧木炭制取二氧化碳
B.加热氯酸钾和少量高锰酸钾的混合物制取氧气
C.稀硫酸跟石灰石反应制取二氧化碳
D.稀硫酸跟铜反应制取氢气
3.(02南昌)下列实验事故的处理方法正确的是 ( )
A.实验桌上酒精灯倾翻燃烧,马上用湿抹布扑灭
B.不慎将酸或碱溶液溅入眼内,立即闭住眼睛,用手揉擦
C.皮肤上溅到较多浓硫酸,赶紧用水冲洗
D.衣服沾上大量浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
4.(02扬州)下列四组物质的溶液,不用其它试剂(可组内两两混合)就能鉴别出来的是 ( )
A.NaNO3、NaCl 、AgNO3、稀HNO3 B.稀HNO3、Na2CO3、NaCl、Na2SO4
C.BaCl2、CuSO4、NaOH、MgCl2 D.BaCl2、K2SO4、Na2CO3、KNO3
5.(01四川)除去下列物质中的杂质,所用试剂和方法不正确的是 ( )
物质 杂质 除杂质所用试剂和方法
A.H2SO4 HCl AgNO3溶液、过滤
B.KNO3 K2SO4 Ba(NO3)2溶液、过滤
C.Cu CuO 盐酸、过滤
D.CaCO3 CaO 水、过滤
二、填空题
6.(02河南)有一包白色固体粉末,可能由:NaCl、Na2SO4、Na2CO3、BaCl2中的一种或几种组成。做实验得出以下结果:
(1)将此固体粉末加入水中,得到白色沉淀,上层清液为无色;
(2)该白色沉淀部分溶于稀硝酸。
从实验结果可判断出,该粉末中一定含有 ,一定不含有 ,可能含有 。
7.(01四川)利用下列图示的实验装置,测定某氧化铜试样中氧化铜的质量分数。
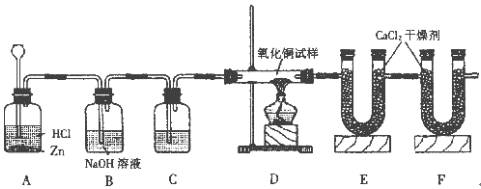
根据实验装置回答下列问题:
(1)装置B的作用是 ,装置B的作用是 。
(2)装置C中盛装的试剂是 。
(3)假设试样中的杂质不反应,且B、C、E装置吸收均完全。取20g试样,若实验前称得U型管E和U型管E中氯化钙的质量为100.8g,充分反应后称得U型管E和U型管E中氯化钙的质量为104.4g,则试样中氧化铜的质量分数为 。
(4)若取消F装置,那么测得的试样中氧化铜的质量分数比实际试样中氧化铜的质量分数 。(填“偏大”或“偏小”)
答 案
应试能力测试:
一、1. B 2. C 3. B 4. B 5. C 6. A 7. C 8. A 9. B 10. C
二、 11. NaOH溶液;浓H2SO4;HCl气;水蒸气;偏低
12. (1) 无明显现象;黑色粉末变成红色
(2) A;D;E
13. 滤纸上所加试剂为浓氨水,脱脂棉上所加试剂为酚酞或两种试剂都加到脱脂棉上;浓氨水
14. 硫酸(或可溶性硫酸盐或可溶性碳酸盐) ① 先生成BaSO4(或BaCO3)沉淀,由BaSO4(或BaCO3)沉淀质量求得BaCl2质量 ② 由固体混合物与BaCl2质量之差,求出NaCl的质量,进而求得NaCl的质量分数。
三、 15. (1) B®C®D®A®B
(2) a;b
(3) 验证并除去水蒸气,吸收反应后生成的水
(4) 验证并除去氯化氢气体
四、 16. (1) 烧杯;玻璃棒;胶头滴管
(2) 红;指示碱液是否被盐酸完全中和
(3) 设R的相对原子质量为x,
![]() ×100%=57.5%,x=23,为钠元素(Na),因此,ROH为NaOH。
×100%=57.5%,x=23,为钠元素(Na),因此,ROH为NaOH。
设NaOH溶液中NaOH的质量分数为y,
HCl + NaOH = NaCl + H2O
36.5 40
200 g×y 73 g×20%
36.5∶40=200 g×y∶73 g×20%,y=6.7%
答:该碱溶液中ROH的质量分数为6.7%。
五、 17. 乙;碳、氢、氧;3∶1∶4
链接中考;
一、1.D 2.B 3.A 4.C 5.A
二、6.(1)Na2SO4、BaCl2、Na2CO3 (2)H2SO4 (3)FeCl3
7.(1)吸收装置A中可能产生的酸性气体, 防止空气中的水蒸气进入装置E中
(2)浓硫酸
(3)80%
(4)偏大