![]()
|
|
学科:化学 |
| 教学内容:初三化学之根据化学方程式的计算 |
【基础知识精讲】
一、涵义:化学计算是从“量”的方面来研究物质及其变化的规律,化学知识是化学计算的基础,数学运算是化学计算的工具.
二、步骤:1.设未知量x
2.写正确的化学方程式
3.找已知与未知之间的质量比;并在相应的化学式下面写出已知量和待求量.
4.列比例式
5.解比例式,求出未知量
6.答
三、从量的角度理解化学反应:在熟悉了一般的计算题的步骤和格式基础上,使学生从定量的角度理解化学反应.
【重点难点解析】
1.书写格式规范是本节的重点
2.含杂质的计算是本节的教学难点
3.关键是明确解题思路:(1)审题 (2)析题 (3)解题 (4)验题
4.容易发生的错误:(1)题意理解不清、答非所问;(2)化学方程式书写错误,使计算失去正确依据;(3)单位不统一,有时把体积等代入;(4)把不纯物质的量当作纯净物的量代入;(5)计算不认真、粗心大意,如求算式量出现错误等.
例1 10克水通电可制得氢气多少g?氧气多少g?
分析 本题是已知反应物的质量,同时求两种生成物的质量,可根据化学方程式的计算步骤,同时设两个未知量,分别与已知量列比例式求解.
解 设10克水通电可制得氢气的质量为x,氧气的质量为y.
2H2O ![]() 2H2↑ + O2↑
2H2↑ + O2↑
36 4 32
10克 x y
![]() =
=![]() =
=![]()
∴ x=1.1g y=8.9g
答:可制得H21.1g, O2为8.9g.
例2 下列根据化学方程式的计算题有错误,简述发生错误的原因,并加以改正.
加热12.25克KClO3,充分反应后可制得氧气多少克?
解 设生成氧气的质量为xg
KClO3 ![]() KCl + O2↑
KCl + O2↑
122.5 32
12.25g x
![]() =
=![]() ∴ x=3.2g
∴ x=3.2g
答:加热12.25gKClO3,可制得O23.2g.
(1)错误原因 ;(2)改正 .
分析 根据化学方程式的计算常发生5类错误,本题的错误在于化学方程式没有配平.
解 (1)化学方程式未配平;
(2 )设反应后可制得O2的质量为xg
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
2×122.5 3×32
12.25g x
![]() =
=![]() ∴ x=4.8g
∴ x=4.8g
答:加热12.25gKClO3,可制得O24.8g.
例3 把干燥纯净的KClO3和MnO2的混合物13.32克,加热至不再产生气体为止,称量剩余物质量为9.48克,求①生成氧气的质量;②剩余物质各是什么?质量分别是多少克?
分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以13.32g-9.48g=3.84g, 这3.84g就是放出O2的质量,这也是解本题的关键.
解 根据质量守恒定律
mO2 = 13.32g – 9.48g = 3.84g
设生成物中KCl质量为xg
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
149 96
x 3.84g
![]() =
=![]() ∴ x=5.96g
∴ x=5.96g
MnO2的质量 9.48g – 5.96g = 3.52g
答:氧气的质量为3.84g,剩余物为KCl和MnO2质量分别为5.96g和3.52g.
例4 在标准状况下,6.2g磷在氧气中充分燃烧,需要氧气多少克?这些氧气的体积是多少升?能生成P2O5多少克?(已知标况下![]() O2=1.43g/L)
O2=1.43g/L)
分析 根据化学方程式的计算要求单位一致,初中阶段只涉及反应物和生成物的质量比计算,所以本题不能直接求出O2的体积,只能先求出生成O2的质量.再根据V气
= ![]() 进行换算.
进行换算.
解 设需要氧气的质量为x,生成P2O5的质量为y.
4P + 5O2 ![]() 2P2O5
2P2O5
4×31 5×32 2×142
6.2g x y
![]() =
=![]() =
=![]() ∴x=8g
y=14.2g
∴x=8g
y=14.2g
VO2 =![]() =
=![]() =5.6L
=5.6L
答:需要氧气5.6升.
例5 含锌65%的锌粒200g,与足量的稀H2SO4反应,可制得H2多少升?(标况下![]() =0.09g/L)
=0.09g/L)
分析 化学方程式中反应物与生成物之间的质量关系指的是纯净物之间的质量关系,不纯物的质量必须转化成纯净物的质量,才能代入化学方程式中进行计算,其换算关系式为:
物质的纯度(%)= ![]() ×100%
×100%
纯净物的质量 = 不纯物的质量×物质的纯度(%)
解 设可制得H2的质量为xg
Zn
+ H2SO4 ![]() ZnSO4+ H2↑
ZnSO4+ H2↑
65 2
200g×65% x
![]() =
=![]()
解得x=4g
![]() H2的体积为
H2的体积为![]() =44.4L
=44.4L
答:可制得44.4升H2.
【难题巧解点拨】
例1 一定质量的KClO3和MnO2的混合物中,MnO2的质量分数为20%,加热后,剩余的固体混合物中MnO2的质量分数升高至25%,则KClO3的分解率是多少?
分析 此题没有给出反应物的质量,但给了反应前后MnO2的质量分数.设MnO2的质量为ag依次算出原混合物质量,KClO3质量,剩余物质量.
解 设MnO2的质量为ag,则原混合物的质量为ag÷20%= 5ag;原KClO3的质量为5ag-ag= 4ag,反应后剩余固体物质的质量为ag÷25%=4ag,根据质量守恒定律,生成mO2=5ag-4ag=ag
设生成agO2,需要KClO3的质量为x
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
245 96
x ag
![]() ∴x=
∴x=![]()
KClO3的分解率=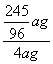 ×100%=63.8%
×100%=63.8%
答:KClO3的分解率为63.8%
例2 将4gH2和O2的混和气体点燃,使其充分反应,得到1.8g水蒸气,则反应前混合物中O2不少于 g,不超过 g.
分析 依题意,有2.2克气体剩余即4g-1.8g=2.2g,设参加反应H2质量为x,O2的质量为y
2H2
+ O2 ![]() 2H2O
2H2O
4 32 36
x=0.2g y=1.6g 1.8g
①若剩余2.2gO2,则参加反应H2不少于0.2g
O2为4g-0.2g=3.8g(即1.6g+2.2g)
②若剩余2.2gH2,则参加反应O2不少于1.6g
H2为4g-1.6g=2.4g(即0.2g+2.2g)
解答 O2不少于1.6g,不超过3.8g.
例3 质量相同的下列金属分别和足量盐酸反应,产生H2最多的是( )
A.Mg B.Al C.Zn D.Fe
分析 本题的常规解题思路为设Mg、Al、Zn、Fe的质量均为ag,然后根据各自的化学方程式分别计算生成的H2的质量,比较大小后得出结论.但此法显然比较繁琐,可用下述方法,找出规律,快速求解,设金属R的相对原子质量为M,与酸反应生成物中化合价为+n价,消耗金属R的质量为mg,则生成H2质量为x
2R + 2nHCl ![]() 2RCln +nH2↑
2RCln +nH2↑
2M 2n
mg x
![]() ∴x=
∴x=![]() m克
m克
规律:在金属质量相同时产生H2质量与该金属的化合价与相对原子质量之比成正比
本题分别为(A)Mg ![]() m=
m=![]() m
m
(B)Al ![]() n=
n=![]() m
m
(C)Fe ![]() =
=![]() m
m
(D)Zn ![]() m=
m=![]() m
m
解答 选(B)
【典型热点考题】
例1 将一定量某种铁的氧化物用足量H2还原后,得到33.6g铁,生成14.4g水,如果氧化物中铁与氧的原子个数比为最简比,试求该铁的氧化物的化学式.
分析 铁的氧化物有多种,设此化学式为FexOy,写出相应化学方程式.
解 设铁的氧化物的化学式为FexOy
FexOy + yH2 ![]() xFe + yH2O
xFe + yH2O
56x 18y
33.6g 14.4g
![]() ∴
∴![]()
则化学式为Fe3O4
答:该铁的氧化物的化学式为Fe3O4.
例2 把7克含杂质的锌片(杂质不与硫酸反应)放在100克足量的稀硫酸里,反应停止后所得混合物总质量为106.8克.
求:(1)根据 定律,反应后生成H2质量是 克.
(2)计算不纯的锌的质量分数.(计算结果精确到0.1%)
解 (1)根据质量守恒定律,反应前后物质质量总和之差即为放出气体的质量.
∴mH2=7g+100g-106.8g=0.2g
(2)设反应的锌的质量为x
Zn + H2SO4 ![]() ZnSO4 + H2↑
ZnSO4 + H2↑
65 2
x 0.2g
![]() ∴x=6.5g
∴x=6.5g
∴ 锌的质量分数为![]() ×100%=92.9%
×100%=92.9%
答:生成氢气0.2克,锌的质量分数92.9%.
例3 0.92g金属Cu与CuO的混合物被H2完全还原后,得到0.752g固体剩余物.求原混合物中含CuO的质量分数?
分析 本题是关于混合物的计算.0.92克物质中含有Cu和CuO,被H2完全还原后,剩下的0.752g固体中只含有Cu,其中的铜一部分是原来的铜,另一部分是还原生成的Cu.本题有四种解法.
解法一 设原混合物中Cu质量为x
H2 + CuO ![]() Cu + H2O
Cu + H2O
80 64
0.92g-x 0.752g-x
![]() ∴x=0.08克
∴x=0.08克
原混合物中Cuo的质量分数=![]() ×100%=91.3%
×100%=91.3%
答:CuO的质量分数为91.3%.
解法二 设混合物中CuO的质量为x,则Cu质量(0.929-x)反应后生成Cu的质量为0.752g-(0.92g-x)=x-0.168g
H2 + CuO ![]() Cu + H2O
Cu + H2O
80 64
x x-0.168g
![]() ∴x=0.84克
∴x=0.84克
原混合物中CuO的质量分数=![]() 100%=91.3%
100%=91.3%
解法三 mCuO
=(0.92g-0.75g)÷(![]() 100%)=0.84g
100%)=0.84g
CuO的质量分数=![]() 100%=91.3%
100%=91.3%
解法四 设原混合物中CaO的质量为x
CuO + H2 ![]() Cu +H2O
固体质量减少
Cu +H2O
固体质量减少
80 64 80-64=16
x 0.92g-0.752g=0.168g
![]() =
=![]() ∴
x=0.84g
∴
x=0.84g
CuO的质量分数= ![]() ×100%=91.3%
×100%=91.3%

【同步达纲练习】
一、选择题(6×10= 60分)
1.甲、乙两人各取2克锌分别与足量的稀H2SO4和稀HCl反应制得的氢气是( )
A.甲的多 B.一样多 C.乙的多 D.无法比较
2.氧化铜跟氢气反应时,如果生成36克水,则被还原的CuO的质量是( )
A.40克 B.60克 C.80克 D.160克
3.完全分解等质量的下列物质:水、KClO3、KMnO4、HgO、得到O2最多的是( )
A.KClO3 B.KMnO4 C.HgO D.H2O
4.2.4g镁、2.7g铝、5.6g铁、6.5g锌分别与足量的稀H2SO4反应,得到H2的质量比依次是( )
A. 1∶1∶1∶1 B.2∶3∶2∶2
C.3∶1∶1∶2 D.1∶2∶2∶3
5.金属X与盐酸反应能生成XCl2,已知9.6g该金属与足量盐酸反应放出0.8gH2,则金属X的相对原子质量是( )
A.24 B.40 C.56 D.65
6.有A和B两种物质,在一定条件下反应生成C和D,已知2克A能和5克B恰好完全反应,生成4克C和3克D,现有6克A和20克B经充分反应后,下列说法正确的是( )
A.生成 C和 D质量之和为26克 B.生成12克 C
C.有1克A剩余 D.生成 10克 D
二、填空题(2×10= 20分)
7.每 份质量P与 份质量O2充分反应生成 份质量的P2O5.
8.加热 克KMnO4可生成6.4克O2,完全反应后剩余固体是
和___________,其质量分别是 和 .
三、计算题(2×10=20分)
9.将109铁与509稀H2SO4反应完毕后,取出剩余的铁,洗涤、干燥后,称其质量为3g.试回答:可制得氢气多少升?(标况下ρH2 = 0.09g/L)
10.将铜和氧化铜的混合物209,用足量的H2还原,待反应完全,得到固体铜16.8g,求:
(1)反应用掉的H2质量是多少?。
(2)原混合物里CuO的质量分数?
【素质优化训练】
1.取7.2gCuxOy的化合物与H2充分反应后,得到6.4gCu,写出该反应的化学方程式.
2.将6克Mg分别与不同质量的O2反应,试将生成MgO的质量填入下表,并回答:
| 氧气的质量(g) | 生成MgO的质量(g) |
| 2 4 8 12 |
(1)当第一次与2gO2反应时,为什么不能生成8gMgO?
(2)从第二次以后,、为什么不断增加O2的质量,生成MgO的质量却不增加?
3.将锌和ZnSO4的混合物20.8g,放入179.6g稀H2SO4中,完全反应后得到200gZnSO4溶液.求:
(1)原混合物中Zn的质量分数?
(2)把200gZnSO4液中的水蒸干,可得到ZnSO4固体多少g?
【知识验证实验】
甲、乙两同学在实验室用氯酸钾加热制取氧气的过程中,假如没有二氧化锰,可以加少量高锰酸钾,同样可以使氨酸钾很快放出氧气.甲同学认为是高锰酸钾起了催化作用,乙同学认为是高锰酸钾分解产生的二氧化锰起了催化作用.你同意谁的观点?并用化学方程式表达你的观点.
【知识探究学习】
难题巧解:锌、铁、镁的混合物4g,与足量的稀H2SO4完全反应,蒸发水份后,得到固体物质1g,试计算生成的氢气的质量?

参考答案:
【同步达纲练习】
一、1.B 2.D 3.D 4.B 5.A 6.B
二、7.124,160,284 8.63.2 ,K2MnO4和MnO2,39.4g,17.4g 9.2.78l 10.(1)0.4g;
(2)80%
【素质优化训练】
1.Cu2O+H2![]() 2Cu+H2O
2Cu+H2O
2.(1)2gO2只能和3gMg起反应;(2)6gMg反应完最多只能得到10gMgO
3.(1)62.5%;(2)40.0g
【知识验证实验】
乙同学的观点是正确的.
2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
【知识探究学习】
解答:本题用常规方法得解四元一次方程组,耗时费力,又容易出错,使用简便方法迎刃而解.
分析:Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+ H2↑
Mg+H2SO4=MgSO4+H2↑![]() M + H2SO4=MSO4+ H2↑(
M指混合物)
M + H2SO4=MSO4+ H2↑(
M指混合物)
0.4g 10g
可得SO4的质量为10g-0.4g=9.6g
H2的质量:![]() ×9.6g=0.2g
×9.6g=0.2g
