初三化学综合测试(A卷)
一、选择题(每小题只有一个选项符合题意)(10分)
1.下列微粒能表示“干冰”的组成的是
A.C B.CO C.CO2 D.2O
2.黑火药是我国古代四大发明之一,把木炭粉、硫磺粉和硝酸钾按一定比例混合,可以制得黑火药,点燃时发生反应:S+2KNO3+3C![]() K2S+3CO2↑+X其中X的化学式为
K2S+3CO2↑+X其中X的化学式为
A.N2 B.NO2 C.SO2 D.N2O5
3.以下是一些常用的表示物质有危险性的危险图标,装运汽油的桶外应贴的图标是
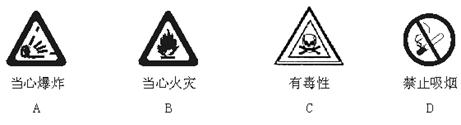
4.据报导:2003年1月28 日,日本政府向国际原子能机构承认,206 kg钚下落不明。这些钚足可以制造出25枚原子弹。钚原子核内有94个质子,其相对原子质量为244,则该原子核内中子数为
A.94 B.150 C.66 D.338
5.漂白精的有效成分是NaClO,其中氯元素的化合价为
A.-1价 B.0价 C.+3价 D.+1价
6.下列混合气体遇火,不可能发生爆炸的是
A.一氧化碳和空气 B.甲烷和氮气
C.氢气和氧气 D.天然气和空气
7.假酒、假盐、假药引起的中毒事件屡有发生,下列物质误食后不会引起中毒的是
A.NaNO2 B.CuSO4
C.CH3OH D.BaSO4
8.下表是市场上销售的一种加碘食盐包装袋上的部分文字说明。你认为下列说法中错误的是
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 35±15 mg/kg |
| 储藏方法 | 通风、防潮 |
| 食用方法 | 待食物熟后加入碘盐 |
A.碘酸钾也是盐
B.碘酸钾不稳定,受热易分解
C.碘酸钾是一种氧化物
D.在KIO3中,碘元素化合价为+5价
9.医学专家曾提醒中老年人,在保健时应当“少吃糖,多饮醋”。下列关于醋酸的化学性质的说法,不正确的是
A.醋酸溶液能使紫色石蕊试液变红色
B.醋酸能跟某些金属反应生成盐和氢气
C.醋酸能跟某些金属氧化物反应生成盐和水
D.醋酸能中和过多的胃酸,所以有健胃作用
10.下列物质加入足量水后振荡,能形成无色溶液的是
A.KMnO4 B.CaCO3
C.Mg(NO3)2 D.FeCl3
二、选择题(每小题只有一个选项符合题意)(10分)
11.正电子、负质子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反。科学家设想在宇宙中可能存在完全由反粒子构成的物质——反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大能量,在能源研究领域前景可观。请你推测,反氢原子的结构可能是
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个带正电荷的质子与一个带正电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
12.自来水常用二氧化氯(ClO2)来杀菌消毒,它能转化为可溶性的氯化物,市场上有一些不法商贩为牟取暴利,用自来水冒充蒸馏水出售,为辨别真伪,你认为可选用的化学试剂是
A.氯化钡溶液 B.氢氧化钠溶液
C.酚酞试液 D.硝酸银溶液
13.松花皮蛋外面的配料有纯碱、食盐、生石灰、草木灰(含有K2CO3),当用水将其调和后包在蛋壳的外面时,这个过程中发生的复分解反应有
A.1个 B.2个
C.3个 D.4个
14.我们已知冰箱致冷剂氟里昂是破坏臭氧层的最凶狠的“杀手”,氟里昂在高温分解时,还产生部分光气(COCl2),这是一种窒息性毒剂,所以现在提倡用无氟环保型冰箱,氟里昂中有一种重要的物质是CF2Cl2(二氯二氟甲烷),有关该物质的说法正确的是
A.它是由碳、氟、氯三种元素组成的
B.它属于氧化物
C.在二氯二氟甲烷中,碳、氟、氧三种元素质量比为1∶2∶2
D.它的相对分子质量为133
15.向10 g质量分数为2%的苛性钠溶液中逐滴加入10 g质量分数为2%的盐酸,反应过程中,溶液的pH随加入盐酸的质量〔m(HCl)〕的变化而发生变化,下列四种图象中,能正确反应这种情况的是(相对原子质量:H—1 O—16 Na—23 Cl—35.5)
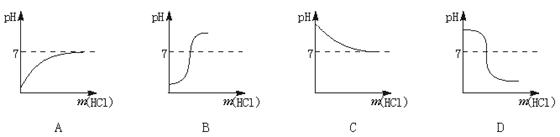
三、选择题(每小题有1~2个选项符合题意)(15分)
16.根据下图溶解度曲线判断,下列说法正确的是
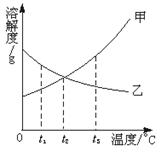
A.t1℃时,甲的溶解度大于乙的溶解度
B.t2℃时,甲、乙的饱和溶液中,溶质质量分数相等
C.t3℃时,甲、乙两物质的饱和溶液降温到t1℃时,都会有晶体析出
D.当甲中含有少量乙时,可采用冷却热饱和溶液结晶的方法提纯甲
17.下列括号中的物质是除去杂质所用的试剂,其中正确的是
A.NaCl中混有少量的Na2CO3(HNO3)
B.CO2中混有少量的CO〔Ca(OH)2〕
C.KNO3中混有少量的CuSO4〔Ba(OH)2〕
D.Fe粉中混有少量的CuO(HCl)
18.现有四种白色固体:①NaCl,②BaCl2,③CuSO4,④Na2SO4,不使用其他试剂(可以用水)就可以把它们区分出来,区分出来的先后顺序可能是
A.②④③① B.②③④①
C.③②①④ D.③②④①
19.将含有K2CO3和BaCl2两种固体的混合物溶于水,得到白色沉淀,过滤后,向滤液中滴加AgNO3溶液产生白色沉淀,加入稀HNO3后白色沉淀完全不溶解,下列判断不正确的是
A.滤液中滴加AgNO3溶液,产生的白色沉淀是AgCl
B.混合物溶于水,过滤后滤液中肯定不含Ba2+
C.混合物溶于水,过滤后滤液中肯定不含CO![]()
D混合物溶于水,得到的白色沉淀是BaCO3
20.“绿色化学”是21世纪化学发展的主导方向,“绿色化学”要求从根本上消灭污染,是一门彻底阻止化学污染产生的科学,它包括“原料的绿色化”“化学反应的绿色化”“产物的绿色化”等内容。其中“化学反应的绿色化”要求原料物质中所有原子完全被利用且全部转入期望的产品中。下列符合“化学反应绿色化”的是
A.2C2H4+O2![]() 2C2H4O
2C2H4O
B.实验室制取CO2
C.2M+N=2P+2Q 2P+M=Q(M、N为原料,Q为期望产品)
D.用铁屑、氧化铜、稀硫酸为原料制取铜:CuO+H2SO4====CuSO4+H2O Fe+CuSO4====FeSO4+Cu
四、填空题(33分)
21.我国禁止使用剧毒鼠药“毒鼠强”,其化学式为C4H8N4S2O4,“毒鼠强”是由____种元素组成的,每个分子中含有____个原子,其相对分子质量为____。(相对原子质量:H—1 O—16 C—12 S—32 N—14)
22.“有其他的物质生成”是判断物质发生化学变化的依据,但在实际化学反应中,一些典型的现象也能帮助我们判断化学反应是否发生。请根据你对化学变化事实的了解,填写下表:
| 发生化学变化的实验 | 主要实验现象 |
| (1)将洁净的铜丝插入盛有Hg(NO3)2溶液的试管里 | |
| (2) | 有白色沉淀生成 |
| (3) | 有气泡产生 |
| (4) |
23.以水、生石灰、盐酸和锌四种物质为反应物,按下列要求各写一个化学方程式:
(1)化合反应:____________________________________________________________;
(2)分解反应:____________________________________________________________;
(3)置换反应:____________________________________________________________;
(4)复分解反应:___________________________________________________________。
24.下图是A、B、C三种固体物质的溶解度曲线,请你根据图示回答下列问题:
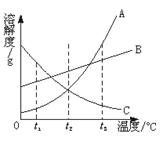
(1)t2℃时,A、B、C三种物质的溶解度大小比较为:______。
(2)当A中含有少量C时,可采用_______的方法提纯A。
(3)当t3℃时,A、B、C三种物质的饱和溶液冷却到t1℃时,三种物质的溶质质量分数由大到小的顺序为________。
25.用明矾作净水剂容易使人摄入过量的铝离子,对人体健康不利。FeCl3是一种很好的净水剂,请用化学方程式表示用三种不同的方法制取FeCl3:
(1)____________________________________________________________________;
(2)____________________________________________________________________;
(3)____________________________________________________________________。
26.下图是国家环境保护总局统计的1999年全国降水污染状况,图中的数据为降雨的 pH。回答下列问题:
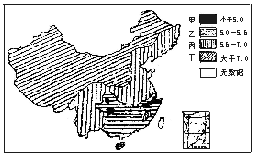
(1)降水酸性最强的地区是____。
(2)某学校化学课外活动小组的同学,取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表:
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 | 4.85 |
由此可见,在测定期间内,该地区降雨的酸性变化情况是______________。
(3)经调查,这一地区有一个硫酸厂(生产过程中产生SO2)使用的燃料主要是煤(煤中含有硫元素)。另外这一地区的生活燃料主要是煤,还有液化石油气。形成这一地区酸雨的主要原因是________和__________产生的SO2污染了空气;为了减少该地区酸雨的发生,采取相应的措施是________________________和________________________。
27.实验探究:
某科学家在科学实验时,不慎将稀盐酸溶液洒到身旁盆花的花瓣上,他惊奇地发现花瓣的颜色发生了改变。于是他想到植物的叶子是否可以用来指示溶液的酸碱性呢?他作了一系列的实验来验证自己的设想,结果发明了用花瓣做酸碱指示剂的方法。
请问:如果是你,你将会设计出一些什么试验方案来验证自己的设想呢?请将实验过程、现象及结论填入下表:
| 设想 | 实验内容 | 观察到的现象 | 解释或结论 |
| (1)是否酸溶液都可以使该花瓣变色呢 | (1)将其他酸溶液也分别滴到该花瓣上 | 花瓣的颜色也发生同样的改变 | 该花瓣可以用来检验某溶液是否是 溶液 |
| (2)NaOH溶液是否也可以使花瓣变色呢? | (2) | 花瓣的颜色果然发生了不同于酸的改变 | |
| (3)是否所有碱溶液都可以使该花瓣变色呢? | (3) |
五、简答题(4分)
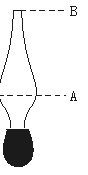
28.如下图所示,先向带肚的滴管中加入显红色的水至A处(约占总体积的一半),再加入无水酒精至B处(即加满),用手指将管口堵住,混合均匀后会产生什么现象?放开手指后又会出现什么现象?由此可以得出什么结论?
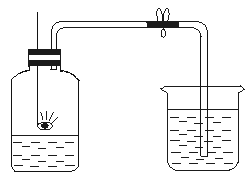
29.用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如下图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的l/5,剩余气体主要是氮气。根据观察的现象推测,氮气具有哪些性质?
六、实验推断题(18分)
30.根据下列实验装置图回答:
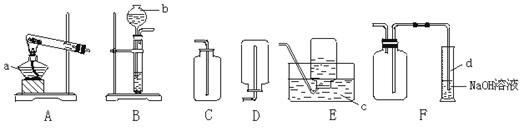
(1)写出标号仪器的名称:a____,b____,c____,d____。
(2)实验室也可用双氧水(H2O2)并用MnO2作催化剂制取少量氧气,其反应为:2H2O2![]() 2H2O+O2↑此时你认为选用的气体发生装置为 (填字母标号),收集装置为 ,若想知道收集的氧气是多少毫升,可选用 装置,方法为_______________________________。
2H2O+O2↑此时你认为选用的气体发生装置为 (填字母标号),收集装置为 ,若想知道收集的氧气是多少毫升,可选用 装置,方法为_______________________________。
(3)若实验室用以下反应制取氨气,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,氨气密度小于空气,极易溶于水,你认为可选用气体发生装置为 ,收集装置为 。
CaCl2+2NH3↑+2H2O,氨气密度小于空气,极易溶于水,你认为可选用气体发生装置为 ,收集装置为 。
31.粗盐提纯的实验一般要经过三个步骤,即溶解、过滤和蒸发。
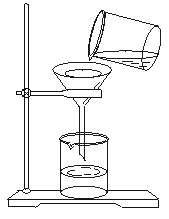
(1) 在溶解粗盐时,要用玻璃棒搅拌,其作用是__________。
(2)指出左图过滤装置中的两处明显错误:_________________、________________。
(3)用改进后的装置进行过滤,但经两次过滤后,滤液仍呈浑浊状,其原因可能是____________、_____________、_______________。
(4)在蒸发时,有液体从蒸发皿中溅出,其原因可能是____________________________。
32.某学生想通过下面装置,测定植物的种子(如黄豆)在萌发过程中是否产生二氧化碳气体。
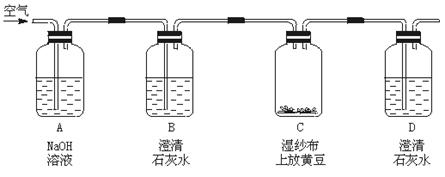
试回答下列问题:
(1)A瓶中NaOH溶液的作用是_______________________________________。
(2)B瓶中澄清石灰水的作用是_______________________________________。
(3)如果黄豆在萌发过程中产生了二氧化碳,则观察到的现象是___________。
七、计算题(10分)
解题可能用到的相对原子质量:K—39 I—127 H—l O—16 N—14 C—12 S—32 Cl—35.5 Na—23 Ba—137
33.在食盐中加入适量的碘酸钾(KIO3)可以有效地防治碘缺乏病。
(1)KIO3的相对分子质量= ;KIO3中碘的质量分数= 。
(2)若经实验分析在100 g加碘盐中含KIO3 0.059 g,则加碘盐中碘的质量分数= 。(写出计算过程)
34.将盛有稀硫酸的烧杯放在天平的左盘上称量,先后加上砝码100 g,20 g,5 g,又将游码移至0.8 g处,已知其中稀硫酸为50 g,投入锌片10 g,当反应完全,没有气泡生成时,再称其总质量为135.6 g,试计算:
(1)生成氢气的质量为多少?
(2)稀硫酸中硫酸的质量分数是多少?
(3)反应后溶液中溶质质量分数是多少?
附:参考答案
一、1.C 2.A 3.B 4.B 5.D 6.B 7.D 8.C 9.D 10.C
二、11.B 12.D 13.B 14.A 15.D
三、16.BD 17.C 18.CD 19.BC 20.AC
四、21.5 22 240
22.(1)铜丝表面覆盖上一层银白色的物质
(2)向盛有AgNO3溶液的试管中滴加NaCl溶液
(3)向盛有Na2CO3粉末的试管中加入稀盐酸
(4)将盛有少量CuO粉末和稀硫酸的试管稍加热 黑色固体溶解,形成蓝色溶液(其他答案合理的,均给分)
23.(1)CaO+H2O====Ca(OH)2
(2)2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
(3)Zn+2HCl====ZnCl2+H2↑
(4)CaO+2HCl====CaCl2+H2O
24.(1)A=C<B
(2)冷却热饱和溶液
(3)B>C>A
25.(1)Fe2O3+6HCl====2FeCl3+3H2O
(2)Fe(OH)3+3HCl====FeCl3+3H2O
(3)Fe2(SO4)3+3BaCl2====2FeCl3+3BaSO4↓
26.(1)甲
(2)酸性逐渐增强,但最后趋于不变
(3)硫酸厂生产过程 生活用煤燃烧 对硫酸厂产生的SO2进行综合治理 改变居民和工厂燃料,用液化气或天然气替代煤(其他答案合理的,均给分)
27.(1)酸性
(2)将NaOH溶液滴到该花的花瓣上 NaOH溶液也可以使花瓣变色
(3)分别将KOH、Ba(OH)2、Ca(OH)2溶液也滴到该花的花瓣上 花瓣的颜色也发生同NaOH溶液一样的改变 该花瓣也可以用来检验某溶液是否是碱性溶液
五、28.混合均匀后,发现滴管的胶头瘪下去了,放开手指后,滴管内液面下降,由此可见,分子间是有间隔的。
29.由于水没有继续流向集气瓶内,说明氮气难溶于水;红磷燃烧耗尽瓶内氧气后便熄灭了,说明氮气不能支持燃烧。
六、30.(1)酒精灯 长颈漏斗 水槽 量筒
(2)B E F 将集气瓶内装满水,气体从左端通入,量取排出水的体积。
(3)A D
31.(1)加快溶解的速率
(2)向漏斗中倒液体时,没有用玻璃棒引流 漏斗末端管口没有紧靠烧杯内壁
(3)漏斗内液体过多,液面高于滤纸边缘 玻璃棒没有靠有三层滤纸的一边,导致滤纸破损 烧杯等仪器未洗干净
(4)没有用玻璃棒不停搅拌,因而使液体局部过热而从蒸发皿中溅出
32.(1)除去空气中的CO2气体,排除空气中的CO2对实验的干扰
(2)检验CO2气体是否已除净
(3)D瓶中的澄清石灰水变浑浊
七、33.(1)KIO3的相对分子质量=39+127+16×3=214
KIO3中w(I)=![]() ×100%=59.3%
×100%=59.3%
(2)加碘盐中,w(I)=![]() ×100%≈0.035%
×100%≈0.035%
34.解:(1)生成氢气的质量:(100 g+20 g+5 g+0.8 g+10 g)-135.6 g=0.2 g
(2)设参加反应的锌的质量为x,硫酸质量为y,反应生成硫酸锌质量为z
Zn+H2SO4====ZnSO4+H2
65 98 161 2
x y z 0.2 g
![]()
x=![]() =6.5 g
=6.5 g
y=![]() =9.8 g
=9.8 g
z=![]() =16.1 g
=16.1 g
w(H2SO4)=![]() ×100%=19.6%
×100%=19.6%
w(ZnSO4)=![]() ×100%=28.6%
×100%=28.6%
答案:(1)0.2 g (2)19.6 (3)28.6%