初三化学综合测试(B卷)
一、选择题(每小题只有一个选项符合题意)(10分)
1.下列物质的用途,主要利用其化学性质的是
A.将干冰喷向舞台,产生了云雾的效果
B.将氦气充入飞艇,使飞艇遨游天空
C.用熟石灰改良酸性土壤
D.用活性炭做防毒面具的滤毒材料
2.下列物质中,属于纯净物的是
A.用饱和硫酸铜溶液降温制得的胆矾
B.病人注射的生理盐水
C.早晨散布于森林中的清新空气
D.建筑工地常用的石灰乳
3.下列物质的化学式书写正确的是
A.家用煤气中的一种有毒气体——H2
B.厨房里常用的纯碱——NaOH
C.急救病人常用的气体——CO2
D.常用来除铁锈的一种挥发性酸——HCl
4.如下描述的四种物质中,属于氧化物的是
A.医疗上用作“钡餐”的硫酸钡
B.作为绿色能源的酒精
C.一种国际上限制排放的温室气体
D.一种常用的含氧酸
5.下列实验操作不正确的是
A.先检验氢气的纯度,再将导管口的纯净氢气点燃,并伸入盛氧气的集气瓶中
B.将系在螺旋状细铁丝末端的火柴点燃,立即伸入盛氧气的集气瓶中
C.将燃烧匙中的木炭点燃后,伸入盛氧气的集气瓶中
D.将燃烧匙中的蜡烛点燃后,伸入盛氧气的集气瓶中
6.下列物质中带点元素的化合价为+3价的物质是

7.下列做法容易导致中毒事件的是
①将煤炉放在浴室中洗澡 ②饮用工业酒精配兑的酒 ③将未知的白色晶体当作食盐炒菜 ④将盛装过农药的瓶子盛装食油或饮料
A.①② B.②④
C.①③④ D.①②③④
8.下面是几种农作物生长时对土壤pH要求的最佳范围:茶5~5.5;西瓜6;大豆6~7;甜菜7~7.5。据此推测,长江三角洲地区(土壤显酸性)最不适宜种植的是
A.茶 B.西瓜
C.大豆 D.甜菜
9.酸雨、温室效应、臭氧空洞是人类面临的三大环境问题,下列说法中不准确的是
A.对燃煤预先采取脱硫措施,可以减少酸雨
B.逐步使用核能、风能、氢能源,可以减缓温室效应
C.使用无氟冰箱等,可以控制臭氧空洞
D.使用液化气代替汽油做汽车燃料,可以减缓温室效应
10.从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是
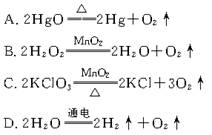
二、选择题(每小题只有一个选项符合题意)(10分)
11.下列错误操作,通常使取得的量或测得的数据偏小的是
A.用量筒量取10mL水,采用俯视方法取得的量
B.用量筒测定液体体积,采用俯视方法测得的数据
C.将砝码放左盘,并使用游码,称量右盘物质质量,测得的质量数据
D.将砝码放在左盘,不使用游码,称量右盘物质的质量,天平平衡时所测得的质量数据
12.下列措施不能达到目的的是
A.氢气还原氧化铜实验完成时,应先停止加热——防止铜被氧化
B.长期保存的食品应真空包装,隔绝空气——防止缓慢氧化
C.煤气泄漏时先关闭阀门,再打开排气扇——防止混合气体爆炸
D.白炽灯里常涂少量红磷作脱氧剂——防止残氧氧化灯丝
13.下列溶液显酸性的是
A.能使紫色石蕊试液变蓝色的溶液
B.能使无色酚酞试液变红的溶液
C.pH=7的溶液
D.pH=4的溶液
14.下列实验操作的先后顺序,正确的是
A.准确配制一定质量分数的硫酸溶液,用同一量筒先量取一定体积浓硫酸,随即再量取一定体积水,然后混合
B.排水法收集氧气结束时,先熄灭酒精灯,再将导管移出水面
C.制取二氧化碳时,先向装置中加入稀盐酸,再加入适量大理石块
D.用一氧化碳还原氧化铜时,先收集尾气,然后再点燃尾气
15.关于化学反应A+B=C+D,下列说法中错误的是
A.该反应可能属于置换反应
B.该反应可能属于复分解反应
C.该反应可能生成两种沉淀
D.该反应可能生成两种金属单质
三、选择题(每小题有l~2个选项符合题意)(15分)
16.由以下粒子结构示意图得出的结论中,错误的是
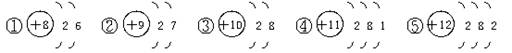
A.①②分别与④或⑤反应,均能形成与③电子层结构相同的粒子
B.上述粒子间能形成AB型、AB2型、A2B型化合物
C.上述粒子形成化合物前后,质子总数、电子总数均发生改变,而质量不变
D.上述粒子形成化合物后,在化合物中均能显示可变化合价
17.用金属的性质解释的有关事实,不正确的是
A.将锌镀在铁的表面,以保护铁不受锈蚀,原因之一是锌的表面能形成保护膜
B.因为铝的表面能形成致密的保护膜,所以铝制品可以盛白醋等物质
C.人类用铜历史早于铁,因为铜冶炼较容易。古代铜文物的发现多于铁文物,因为铁更易锈蚀
D.用铁桶配制的波尔多液中,因为生成铜、铁的氢氧化物等,药效大大降低
18.现代科学又发现了H3、C60、C90、C240、N5、N60……,据此可作出的推测是
①同一种元素可以形成多种单质 ②单质可能存在复杂的分子结构 ③单质的研究具有广阔的前景 ④单质的利用,前途无量 ⑤同种元素形成的单质之间存在更多的互相转化
A.①② B.③④
C.②⑤ D.①②③④⑤
19.现有如下图所示装置,先向A杯中注入蒸馏水,再向其中滴入几滴酚酞试液。然后向B杯中注入浓氨水,把钟罩罩上。可以观察到A中液体逐渐变红。此实验可以作出的科学结论是
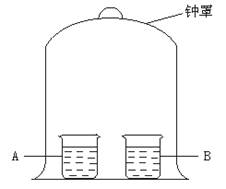
①蒸馏水不显碱性 ②蒸馏水具有挥发性 ③空气中存在水蒸气 ④氨水显碱性,含OH- ⑤氨水具有挥发性 ⑥氨溶于水 ⑦氨分子的质量小于水分子
A.①②③ B.①④
C.④⑤⑦ D.⑤⑥
20.根据下图,可以作出的推论是
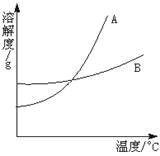
A.从接近饱和的A、B混合溶液中直接分离A、B,只能用降温结晶法
B.在任何温度下,都能配制质量分数相同的A或B的饱和溶液
C.图象中的A、B可以代表任何物质
D.图象中的A、B物质,不可能是气态物质
四、填空题(33分)
21.到目前为止,全球拥有化合物超过2000万种,其中部分是由碳、氢、氧、硫、钠、钙中的某些元素组成的。请用上述元素按以下分类各写一种物质的化学式:
(1)石灰石的主要成分:________。
(2)一种微溶性的碱:________。
(3)一种不稳定的酸:_________。
(4)两种大气污染物:__________。
22.(1)某仓库贮存的金属镁,因为保管不善引发火灾,某人试图用CO2灭火,结果镁继续燃烧,并有黑色固体和白色固体两种物质生成,试写出该反应的化学方程式:_______。
(2)某药品橱内长期存放的固体氢氧化钠,在用于科学实验前,应该检验其是否变质,试写出检验所依据的一个主要化学方程式:______________________。
(3)酸雨的酸性主要来自雨水中含有的硫酸。大气污染物二氧化硫溶于水生成亚硫酸,亚硫酸具有还原性,易被空气中氧气氧化为硫酸,导致雨水成为酸雨。试写出雨水中亚硫酸被氧化为硫酸的化学方程式:_________________。
(4)汽车尾气排放出的CO、NO超标,必须安装尾气净化装置。该净化装置经催化剂催化将有毒气体转化为空气中的两种成分,试写出该反应的化学方程式: _________。
23.某学生要验证一瓶酸溶液是硫酸和盐酸的混合溶液,进行下面的实验:(1)将溶液滴在pH试纸上,溶液的pH<7,显酸性;(2)取溶液少许注入试管中,加入过量氯化钡溶液,产生不溶于稀硝酸的白色沉淀;(3)过滤,向滤液中滴加硝酸银溶液,又生成不溶于稀硝酸的白色沉淀。
你认为上述操作的结论只能是_______________;若要达到验证的目的,上述实验中所用试剂应更换的是:____换为____;若该混合液还混有其他无机酸,你认为最有可能还含有的一种酸是__________
24.质量守恒定律的微观解释是:因为化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质(生成物)的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
根据所学“原子结构”和“原子在化学反应中趋向稳定结构”的知识,解释:
(1)为什么反应前后原子的种类没有改变?
(2)为什么反应前后原子的质量没有改变?
25.在烧杯①~⑧中分别装入下列物质,露置于空气中一段时间后,烧杯中有些物质发生了变化。请你根据质量是否变化、是否变质等,将它们分为比较合理的三种类型(注:每种类型内,可以再细分)。
①烧碱固体;②碳酸钠晶体;③生石灰;④氯化钠固体;⑤浓盐酸;⑥浓硝酸;⑦浓硫酸;⑧酒精
第一类型__________________________________
第二类型__________________________________
第三类型__________________________________
26.由甲、乙两种不同的可溶性盐组成的混合物。为分析其成分,进行下列实验:(假定下列各步反应都恰好完全进行)
(1)取少量混合物加入适量水中充分溶解,无沉淀生成,也没有气体放出,得到无色溶液A。
(2)向A中加入适量BaCl2溶液后过滤,得到白色沉淀B和无色滤液C。
(3)向白色沉淀B中滴加稀硝酸,沉淀不溶解。
(4)向无色滤液C中加入适量AgNO3溶液后过滤,得到白色沉淀D和只含NaNO3的溶液。根据以上实验,推断:
①B是____,D是____。
②将甲和乙的可能性填入下表:
| 甲 | ||||
| 乙 |
五、简答题(4分)
27.金陵晚报以《莫名气体掀翻窨井盖》报导:2003年2月7日下午,升州路上的一条居民弄堂“平地响起一声惊雷”,随着一声巨响,3个窨井盖被一股莫名气体全部掀开,现场炸得凌乱不堪,幸无人员伤亡。
据查,疏散居民后,煤气公司抢修人员持仪表测量并无煤气,也无煤气管线。
从以上报导内容,你认为该气体可能是什么?它是从哪里来的?为什么会爆炸?
28.除了水能供给人类饮用,维持动植物和人类生命以外,试说出水是人类宝贵资源的两点理由。
六、实验推断题(19分)
29.回答下列各典型装置的一个问题。
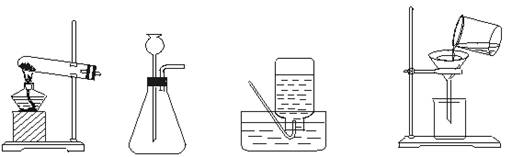
① ② ③ ④
(1)图①装配时应注意的两点问题是:
(2)图②装置对反应的要求是:
(3)图③装置不能收集的气体是:
(4)说出图④操作的错误是:
30.取四朵用石蕊溶液染成紫色的干燥小花。第一朵小花喷上稀醋酸,第二朵小花喷上水,第三朵小花直接放入盛满二氧化碳的集气瓶中,第四朵小花喷上水后,再放入盛满二氧化碳的集气瓶中。
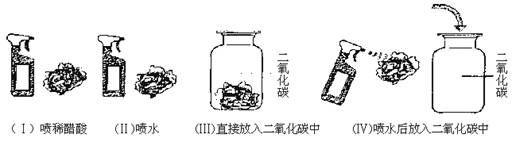
结果发现,(Ⅰ)(Ⅳ)实验中石蕊的颜色由紫色变为红色,而(Ⅱ)(Ⅲ)实验中石蕊的紫色不变。
试就上述实验,推断出具有充分说服力的两点结论:
(1)_____________________________________________________________________
(2)_____________________________________________________________________
31.现有下图所示装置,用于实验设计时,假定每个装置均能充分反应。
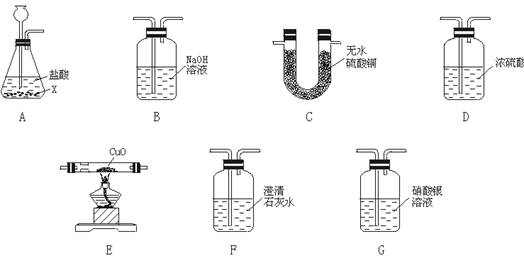
现将未知固体混合物X放入A中与盐酸反应,发现产生大量气泡。某学生认为产生的气
体可能为H2、CO2、H2O、HCl的混合物,为检验气体的成分,可以考虑如下实验设计:
(1)检验该气体中可能混有H2O,将A装置与_______装置相连。(填序号,下同)
(2)检验该气体中可能混有HCl,将A装置与____装置相连。
(3)检验该气体中可能混有CO2,装置的连接顺序是A-( )-( )。
(4)检验该气体中可能混有H2,装置的连接顺序是A-( )-( )-( )-( )。
七、计算题(9分)
(相对原子质量:H—1,O—16,S—32,Cu—64,Zn—65)
32.电解水时,常在水中加入少量硫酸以增加水的导电性,硫酸本身并不被分解。现用25 g 8%的硫酸溶液进行电解水的实验,过一段时间后,测得硫酸的质量分数变为10%。试计算被电解水的质量和同时产生氢气的质量各是多少?
33.我国约在南北朝时就开始冶铸黄铜,黄铜是铜和锌的合金,它可以用来制造机器、电器零件及日用品。为了测定某黄铜样品中铜的质量分数,取10 g该黄铜样品加入到50 g稀硫酸中,恰好完全反应,产生氢气0.1 g。请计算:
(1)该黄铜样品中铜的质量分数。
(2)原稀硫酸溶液中溶质的质量分数。
附:参考答案
一、1.C 2.A 3.D 4.C 5.B 6.A 7.D 8.D 9.D 10.B
二、11.A 12.C 13.D 14.D 15.D
三、16.CD 17.B 18.D 19.BD 20.D
四、21.(1)CaCO3
(2)Ca(OH)2
(3)H2CO3(或H2SO3)
(4)SO2(或H2S)、CO
22.(1)CO2+2Mg![]() 2MgO+C
2MgO+C
(2)Na2CO3+2HCl====2NaCl+CO2↑+H2O
(3)2H2SO3+O2====2H2SO4
(4)2CO+2NO![]() 2CO2+N2
2CO2+N2
23.说明含硫酸,不能说明一定含盐酸 氯化钡溶液 硝酸钡溶液 硝酸
24.(1)因为反应前后原子只是通过改变核外电子数达到稳定结构,核内质子数(核电荷数)没有改变,因此原子种类不变。
(2)因为电子的质量很小很小,在原子质量中可以忽略不计,因此核外电子数的变化,可视作原子的质量不变。或在化学反应中,电子在原子之间发生转移,但并未消失,原子质量不变。
25.(说明:质量变化有三种类型,因此,选择质量变化分类较方便)
第一,杯内质量没有变化,也不变质的是氯化钠
第二,杯内质量增加,不变质是浓硫酸,变质的是烧碱、生石灰
第三,杯内质量减少,不变质的是浓盐酸、浓硝酸、酒精,变质的是碳酸钠晶体(其他合理答案也算对)
26.①BaSO4 AgCl
②
| 甲 | Na2SO4 | NaCl | Na2SO4 | NaNO3 |
| 乙 | NaCl | Na2SO4 | NaNO3 | Na2SO4 |
五、27.该气体可能是窨井内有机物长期缓慢发酵产生的沼气,沼气与空气混合后,(达到爆炸极限,)遇明火或受热发生爆炸。(其他合理推断也算对)
28.①水在工农业生产和化工生产中是常用的溶剂;
②水是制取很多化工产品的反应物,例如制H2、重要酸、碱、化肥等。
六、29.(1)管口略向下倾斜;铁夹夹在试管中上部等。
(2)适用于固态和液态反应物或液态和液态反应物在不受热的条件下有气态物质生成的反应。
(3)溶于水或能与水发生反应的气体。
(4)未用玻璃棒引流;漏斗末端未贴紧烧杯内壁。
30.(1)二氧化碳和水能发生化学反应。
(2)二氧化碳和水反应的生成物与醋酸具有相似的性质。(其他合理答案也算对)
31.(1)C
(2)G
(3)G F
(4)B D E C
七、32.解:设反应一段时间后,剩余液体质量为x
25 g×8%=x×10%
x=20 g
则被电解的水质量为5 g
同时生成氢气的质量为5 g×![]() =0.56 g
=0.56 g
答:被电解水为5 g,同时生成0.56 g氢气。
33.解:(1)设黄铜中锌的质量为x,稀硫酸中硫酸的质量为y,
Zn+H2SO4====ZnSO4+H2↑
65 98 2
x y 0.1 g
![]()
x=![]() =3.25 g
=3.25 g
y=![]() =4.9 g
=4.9 g
黄铜中w(Cu)=![]() ×100%=67.5%
×100%=67.5%
硫酸溶液中w(H2SO4)=![]() ×100%=9.8%
×100%=9.8%
答:略