初三化学第一学期期中考试
试卷
考试时间100分钟(满分100分)
班级__________ 姓名___________ 总分___________
相对原子质量:H:1 Na:23 C:12 O:16 S:32 Cl:35.5 Ca:40 K:39 Fe:56 Mn:55 Zn:65 Cu:64 Al:27 Mg:24 N:14 P:31
一.单项选择题(将正确答案序号填入下表,每题2分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
1.从物质分类的角度看,河水属于( )
A.化合物 B.氧化物 C.单质 D.混合物
2.下列变化中,不属于化学变化的是( )
A.铁生锈 B.镁带燃烧 C.空气液化 D.火药爆炸
3.下列性质中,不属于化学性质的是( )
A.氢气具有可燃性 B.铁能在潮湿的空气中易生锈
C.氢气比氧气密度小 D.碱式碳酸铜能受热分解
4.下列物质中含氧分子的是( )
A.二氧化锰 B.二氧化硫 C.高锰酸钾 D.空气
5.保持水化学性质的最小粒子是( )
A.氧原子 B.氢原子 C.氧分子 D.水分子
6.下列仪器中,不能用于加热的是( )
A.试管 B .烧杯 C.燃烧匙 D.量筒
7.O2表示氧气,还可以表示( )
①氧元素 ②一个氧分子 ③二个氧元素 ④氧气由氧元素组成
⑤二个氧原子构成一个氧分子 ⑥二个氧原子
A.①②③ B.②④⑤ C.②④⑥ D.①④⑤
8.硫在氧气中燃烧,火焰的颜色为( )
A.蓝紫色 B.浅蓝色 C.红色 D.黄色
9.地壳中含量最多的金属元素是( )
A.铁 B.铝 C.硅 D.氧
10.下列物质中属于氧化物的是( )
A.铜绿 B.水 C.氯酸钾 D.液态氧
11.一种元素与另一种元素的本质区别是( )
A.最外层电子数 B.电子数 C.中子数 D.核电荷数
12.发现电子的是下列哪位科学家( )
A.拉瓦锡 B 道尔顿 C 阿伏加德罗 D 汤姆生
13.下列操作正确的是:( )
A用托盘天平准确称取6.25克某固体 B 用滴管悬空滴加液体
C 用50ml量筒量取8ml水 D 用烧杯或量筒溶解固体
14.下列叙述中,正确的是( )
A 纯净物一定是同种分子构成的
B 由同种分子构成的物质一定是纯净物
C 纯净物一定是由同种元素组成的
D 混合物一定是由多种元素组成的
15.鲨鱼是目前发现的唯一不患癌症的动物,其体内含有一种抗癌物质:
C30H50,关于该物质的说法正确的是( )
A.该物质由30个碳原子和50个氢原子构成
B.该物质是一种混合物
C.该物质的相对分子质量是410
D、该物质是目前发现的唯一一种治癌药物
16.科学家发现固体硫磺中含有S8分子,下列有关说法正确的是( )
A S8是一种新型化合物 B S8是一种单质
C S8的分子质量为256 D 硫磺燃烧后产生8个SO2分子
17.下列说法不正确的是( )
A 工业生产中的“三废”指的是废渣、废水和废气
B 农业上农药、化肥的大量使用不会造成环境污染
C 生活污水和垃圾的任意排放会造成环境污染
D 饮用工业酒精勾兑的白酒会对人的健康造成严重危害
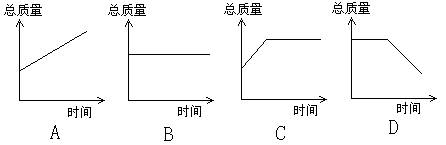
18.木炭在耐高温的容器中密封(内含空气)加热,下图能正确表示容器里
所盛物质总质量变化的是( )
19.当SO2与SO3的质量比为1:1时,其所含的分子数之比为( )
A 1:1 B 2:1 C 5:4 D 3:5
20.在化合物X2Y和YZ2中,Y的质量分数约为40%和50%,则化合物X2YZ3中Y的质量分数约为( )
A 20% B 25% C 30% D 35%
二、填空题(共24分)
1、我国是文明古国,在化学工艺像造纸、________、烧瓷器等发明很早,商代就制造出精美的__________,春秋战国时期就会_____________。
2、写出下列物质的化学式:
二氯化钡__________; 二氧化铅 ;四氟化硅 。
3、写出下列化学符号中数字的含义:
①H2O______________________________ ②2H___________________
③N2______________________________ ④2CO__________________
4、用化学符号表示下列意义
①四个氮气分子_________ ②六个钙原子____________
③氦气___________ ④一个氢原子____________
5、下列物质中:①二氧化碳 ②海水 ③氢气 ④高锰酸钾 ⑤铁、⑥硫、⑦五氧化二磷、⑧铜、⑨液态空气、⑩碳,选择合适的代号填空:
属于氧化物的是_____________;属于混合物的是________________;
属于非金属单质的是 _____________;相对分子质量最大的化合物是____
6、某物质的化学式为A2B3,A与B的质量比为9:8,则其相对原子质量之比为________________
7、Na2S、Na2SO3、Na2SO4三种物质的混合物,其中硫元素的质量分数为32%,则氧元素的质量分数为_______________
三、写出下列反应的文字表达式,并说明基本反应类型(6分)
1、实验室用高锰酸钾加热制氧气:
文字表达式__ __,反应类型 ;
2、铜绿受热分解
文字表达式__ __,反应类型 ;
3、磷在空气中燃烧:
文字表达式__ __,反应类型 ;
四、推断题(8分)
今有A、B、C、D四种元素,A元素的原子中无中子;B元素在地壳中质量分数居金属中第二;C元素与A元素能形成A2C型化合物,其中C元素的质量分数为94.12%;D元素能与C元素形成CD2型化合物,其中C、D两种元素的质量比为1:1,试推断A、B、C、D各为什么元素(用元素符号表示):
A________; B_________; C_________; D__________。
五、实验题(12分)
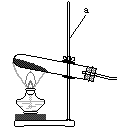
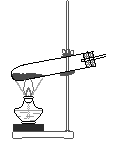
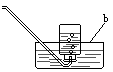
今有A、B、C、D、E、F、六种装置如图所示,按下列要求回答有关问题(所选装置用字母表示,假定连接装置用的胶皮管和导气管已备)。
![]()
![]()
![]()
A B C D E F
1、写出图中标有字母的仪器名称:a____________;b____________。
2、用高锰酸钾制氧气并收集到不混有空气的氧气,最好选用装置______和_______。实验前首先应________________________,然后再装入药品进行实验。实验完成停止加热时,应先_______________________,后____________________,这是为了防止________________________。
3、实验室用高锰酸钾制氧气与用氯酸钾制氧气不同之处在于用高锰酸钾制氧气的发生装置需_________________________________________,其作用是 _______________________________________________。
4、 做铜绿受热分解并检查生成气体的实验,其装置应选_____ 和_____
六、计算题(10分)
1、求CuSO4·5H2O(胆矾)中铜、硫、氧、氢四种元素质量比。(4分)
2、已知一个SO2分子的质量为n千克,一个SO3分子的质量为m千克,若以一个硫原子质量的1/32 作为标准,求SO2的相对分子质量。(6分)