初三化学期末检测卷
一、 选择题
你了解身边的化学吗?关注身边的化学知识,你将会揭开生活中的许多奥秘
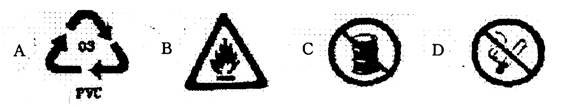
1.下图表示塑料包装品回收标志的是( )
2.“84消毒液”的有效成分是次氯酸钠(NaClO)其中Cl元素的化合价为( )
A.-1 B.+1 C.+3 D.+5
3.生活中常见的下列物质,不属于溶液的是( )
A.糖水 B.蒸馏水 C.碘酒 D.汽水
4.下列做法不能起防锈作用的是( )
A.保留铁制品上的铁锈 B.在铁制品表面镀锌
C.在金属机械上涂油 D.在车船的表面刷油漆
5.根据你的生活经验,下列做法不正确的是( )
A.炒菜时油锅不慎着火,迅速盖上锅盖 B.用燃着火柴棒检查液化气钢瓶是否漏气
C.运动出汗之后,可适当饮用食盐水 D.长久保存的文字资料,须用碳素墨水书写
6.日晒海水可以得到食盐固体,其原因是( )
A.受热时食盐的溶解度降低 B.受热时食盐的溶解度显著增大
C.受热时海水中的水份蒸发 D.受热时海水发生分解
7.我国推广食用的加碘食盐是在食盐(NaCl)中加入一定量的碘酸钾(KIO![]() )。关于加碘食盐的下列说法不正确的是(
)
)。关于加碘食盐的下列说法不正确的是(
)
A.食盐加碘的目的是补充人体需要的碘元素 B.加碘食盐是混合物
C.加碘食盐是化合物理 D.加碘食盐中至少含有5种元素
8.现代医学证明,人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着。碱式磷酸钙的分子中除钙离子外,还有一个氢氧根离子和三个酸根离子(PO![]() )。则碱式磷酸钙的化学式是(
)
)。则碱式磷酸钙的化学式是(
)
A.Ca![]() (OH)(PO
(OH)(PO![]() )
)![]() B.
Ca
B.
Ca![]() (OH)(PO
(OH)(PO![]() )
)![]()
C. Ca![]() (OH)(PO
(OH)(PO![]() )
)![]() D.
Ca
D.
Ca![]() (OH)(PO
(OH)(PO![]() )
)![]()
9.2003年2月1日,美国“哥伦比亚号”航天飞机在空中失事。有专家分析认为,其原因可能是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦可以起隔热和保护作用,这主要是因为石墨( )
A.能导电 B.熔点高、耐高温,化学性质稳定
C.密度小 D.硬度小,有润滑作用
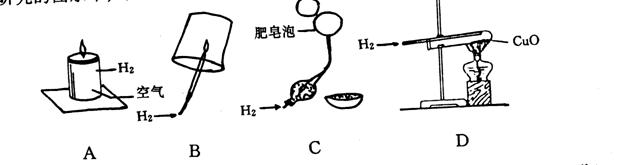
10.随着科学的进步和保护环境的需要,人们对使用能源的认识也随之提高,下列对氢能源研究的图示中,只能说明氢气物理性质的是( )
二、选择题
化学与科学、技术和社会密切相关
11.自2003年6月1日开始,三峡蓄水工程正式启动,中央电视台以“见证三峡135”为题进行了全面报道。三峡工程的年发电量,相当于每年燃烧的3000万吨原煤产生的电能,三峡工程全面启动将有助于控制
①温室效应 ②白色污染 ③SO![]() 排放
④烟尘排放
排放
④烟尘排放
A.①②④ B. ①②③ C. ①③④ D. ②③④
12.液化石油气作为燃料,已普遍进入城市家庭,它是含有下列物质的混合物,在常压下,这些物质的沸点如下表示:
| 物质名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
| 沸点/℃ | -88.6 | -42.2 | -0.5 | 36.1 | 69.2 |
在常温下使用至无气体放出时,钢瓶中常剩余一些液态物质,这些物质最有可能是
A.乙烷、丙烷和丁烷 B.乙烷和丙烷
C.只有乙烷 D.戊烷和己烷
13.中国科学技术大学钱逸泰教授等以CCl![]() 和金属钠为原料,在700℃制造出纳米级金刚石粉末。该成果发表在世界最权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此的一些“理解”,不正确的是(
)
和金属钠为原料,在700℃制造出纳米级金刚石粉末。该成果发表在世界最权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此的一些“理解”,不正确的是(
)
A.金刚石属于金属单质 B.制造金刚石过程中发生了化学变化
C.CCl![]() 是一种化合物
D.这个反应是置换反应
是一种化合物
D.这个反应是置换反应
14.硫酸亚铁(FeSO![]() )可用于治疗缺铁性贫血患者每天需补充1.40g铁元素,服用的药物中应含硫酸亚铁的质量至少为(
)
)可用于治疗缺铁性贫血患者每天需补充1.40g铁元素,服用的药物中应含硫酸亚铁的质量至少为(
)
A.3.80g B.6.95g C.10.00g D.3.18g
15.科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力。已知增胱氨酸的化学式为C![]() H
H![]() NSO
NSO![]() 。下列说法错误的是(
)
。下列说法错误的是(
)
A.一个半胱氨酸的分子由14个原子构成 B.C、H、N、S、O元素的质量比为3:7:1:1:2
C.半胱氨酸的相对分子质量为121 D.半胱氨酸由5种元素组成
三、选择题
应用化学知识,你能分析许多问题。
16.纳米是一种长度单位,纳米材料被誉为21世纪最有前途的新型材料。我国在纳米碳管的研究上居世界领先地位,在纳米碳管中碳原子按一定方式排列。下列叙述中错误的是( )
A. 纳米材料将对人类文明的发展产生积极影响 B.纳米碳管是用一种叫做“纳米”的物质制成的材料
C.纳米碳管在氧气中完全燃烧生成CO![]() D.纳米碳管是由碳元素组成的单质
D.纳米碳管是由碳元素组成的单质
17.在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前物质的质量如下:
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 4 | 10 | 1 | 21 |
| 反应后质量/g | 0 | 12 | 15 | 待测 |
已知X的相对分子质量为n,Q的相对分子质量为2n,下列推理正确的是( )
A.反应后Q的质量为9g B.反应后生成15Gz
C.反应后Y与Q发生改变的质量之比为1 :1 D.该反应方程式中X与Q的化学计量数之比为2 :3
18.关于下列物质的转化过程:H![]() →H
→H![]() O CO→CO
O CO→CO![]() C→CO
C→CO![]() ,说法不正确的是(
)
,说法不正确的是(
)
A.都能通过化合反应实现 B.都能通过置换反应实现
C.都能通过和单质反应实现 D.变化前后都有元素化合价改变
19.某气体可能由初中化学中常见的一种或多种气组成,经测定其中只含有碳、氧两种元素,碳、氧元素质量比为1:2,则关于该气体的说法正确的是( )
A.一定是纯净物
B.一定是CO、CO![]() 的混合物
的混合物
![]() C.该气体最多可能的组合有2种 D.该气体最多可能的组合有3种
C.该气体最多可能的组合有2种 D.该气体最多可能的组合有3种
20.1998年中国十大科技成果之一合成纳米氮化镓。已知镓(Ga)原子结构示意图为
氮原子结构示意图为 。由氮化镓的化学式是( )
A.Ga![]() N
N![]() B.Ga
B.Ga![]() N
N![]() C.GaN
D.Ga
C.GaN
D.Ga![]() N
N![]()
 四、填空题
四、填空题
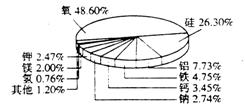
21.如图表示的是地壳里所含各种元素的质量分数。请根据下图回答下列问题:
(1)图中表示出的金属元素有______________种;
(2)地壳中铝元素的含量为______________;
(3)地壳中含量最多的非金属元素与含量在金属元素中占第二位的金属元素之间,形成化合物的化学式可以是______________。
22.病人在医院接受静脉注射或滴注时,常用到生理盐水即氯化钠注射液。右下图是某药业公司生产的氯化钠注射液包装标签上的部分文字。请回答:
(1)该注射液里的溶质是________________。
 (2)常温下,一瓶合格的氯化钠注射液密封放置一段时间后,是否会出现浑浊现象?为什么?__________。
(2)常温下,一瓶合格的氯化钠注射液密封放置一段时间后,是否会出现浑浊现象?为什么?__________。
氯化钠注射液
【规格】100mL 0.9g
【注意】使用前发现溶液中有絮状物、
瓶身细微破裂等均不可使用。
【贮藏】密封保存
23.化学用语是一种特定的化学语言,它表示一定的化学含义,需加以区分。
![]()
![]() (1)若用“ ”表示氢原子,则H
(1)若用“ ”表示氢原子,则H![]() 的图示为_____________,则2H的图示为______________。
的图示为_____________,则2H的图示为______________。
(2)若钠的原子结构为 ,硫的原子结构示意图为 ,则钠离子结构示意图为
___________,而硫离子结构示意图为_______________。
(3)离子电荷数与化合价应表示方法不同:3个氯离子应写成___________,则三氧化二铁中铁元素化合价应表示为______________。
(4)相同的元素可以组成不同的原子团,如锰酸根离子写成_____________,高锰酸根离子写成___________。
24.为了履行国际社会《关于消耗臭氧层物质的蒙特利尔议写书》,我国政府决定自2003年6月1日起在全国范围内禁止使用“CTC”作为清洁剂,“CTC”又称为四氯化碳,是常用的服装干洗剂,也是修正液(又涂改液)中的一种溶液,还是一种优良的灭火剂。根据以上信息回答:
(1)“CTC”的化学式为__________,其中碳元素的化合价为_______________。
(2)推测“CTC”的物理性质和化学性质各一种。
①物理性质_______________; ②化学性质_______________。
25.A是某工厂废旧车床表面上红色固体的主要成人,B、C、F都是单质,D、F都没有颜色和气味,A~F是初中化学常见物质。它们之间的相互转化关系如下图:
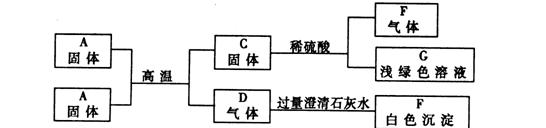
请回答:(1)写出下列物质的化学式:C______________;F______________。
(2)写出气体D和过量澄清石灰水反应的化学方程式_____________。
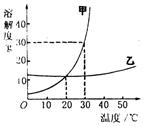 26.小明绘制的两种固体物质的溶解度曲线如下图所示:
26.小明绘制的两种固体物质的溶解度曲线如下图所示:
(1)30℃时,甲物质的溶解度为___________。
(2)由上图还可获得的信息有:①___________;②_____________。
27.科学家正研究在太空建一座把太阳光变成激光的装置,然后用激光照射添加了催化剂二氧化钛(TiO![]() )的水,水就能有效地分解产生氢气和氧气,即2H
)的水,水就能有效地分解产生氢气和氧气,即2H![]() O
O![]() 2H
2H![]() ↑+O
↑+O![]() ↑。某同学看到此化学方程式,即想到以下两点:①水在激光和催化剂TiO
↑。某同学看到此化学方程式,即想到以下两点:①水在激光和催化剂TiO![]() 的作用下,能分解氢气和氧气;②每36g水可以分解生成4g氢气和32g氧气。
的作用下,能分解氢气和氧气;②每36g水可以分解生成4g氢气和32g氧气。
你还能想到更多吗?请将你的想法填写在下空的空格中(再任写两点)。
①__________________;②______________________;
28.下现观点皆是错误的。请各找一个学过的化学方程式,否定以下错误观点,例如:“氧化反应一定是化合反应。”说明它错误的实例:CH![]() +2O
+2O![]()
![]() CO
CO![]() +2H
+2H![]() O
O
| 错误说法 | 否定例证(化学方程式) |
| (1)化合反应的反应物都是单质 | |
| (2)分解反应的生成物都是化合物 | |
| (3)置换反应的反应物中一定有金属单质 | |
| (4)原子团在反应前后一定不可拆分 |
29.下表中填入的是核电荷数从11到18的部分元素的名称、原子结构、元素化合价:
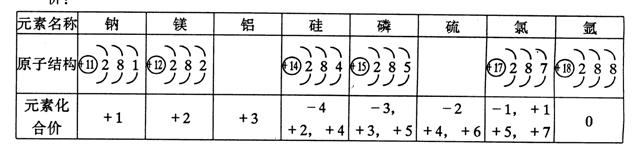
(1) 从下列供选择的4种粒子结构示意图,选择正确答案填入上表空格内(填序号)。
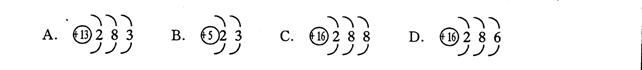
(2)通过该表可以发现元素化合价的一些规律是(至少写4条规律):
①_________________ ③____________________
②_________________ ④____________________
五、有关化石燃料的探究
30.12月23日重庆市开县的川东北气矿一矿井发生天然气“井喷”,造成重大伤亡。据报道此次重大人员伤亡事故的原因是天然气中含有硫化氢(H![]() S)等有毒气体,人吸入就会中毒症状甚至死亡。天然气的主要万分是甲烷,甲烷本身没有毒,西气东输的天然气很快将进入南京,在家庭、企业使用之前,会进行净化处理,剔除有毒成分。南京35万管道煤气用户3年内将全部用上天然气。
S)等有毒气体,人吸入就会中毒症状甚至死亡。天然气的主要万分是甲烷,甲烷本身没有毒,西气东输的天然气很快将进入南京,在家庭、企业使用之前,会进行净化处理,剔除有毒成分。南京35万管道煤气用户3年内将全部用上天然气。
(1)煤气的主要成分CO燃烧的化学方程式为__________;天然气的主要成分CH![]() 燃烧的化学方程式为___________。
燃烧的化学方程式为___________。
(2)实验证明,在同温同压下,相同体积的任何气体中含有的分子数相同。则在同温同压下,相同体积的CO和CH![]() 分别充分燃烧,消耗氧气较多的是______________。
分别充分燃烧,消耗氧气较多的是______________。
(3)燃气灶是由灶体、进燃气管、进空气管、电子天关等部件组成。目前的管道煤气用户改用天然气,必须对燃气灶加以改造。如果进燃气管的直径不变,改造后的燃气灶与原来的相比,进空气管的直径将(填“增大”或“减小”)_____________。
(4)眼下正值数九寒冬,南京频频发生居民煤气中毒事故,百江液化气公司的液化气专家解释说,很多煤气中毒的事故并非是当事人吸入了泄漏的液化气中毒,而是由于液化气燃烧不充分产生大量一氧化碳等有害气体而导致中毒的。有人认为家里放上一盆水就可以预防一氧化碳中毒,你认为科学吗?为什么?_____________;请你谈谈如何在冬季预防使用燃气导致的中毒事件_____________;
(5)一定质量的甲烷与氧气在一定条件下反应,生成物CO、CO![]() 和H
和H![]() O的总质量为12.4g,其中H
O的总质量为12.4g,其中H![]() O的质量为6.3g,则参加反应的甲烷质量为_________g,产物中CO与CO
O的质量为6.3g,则参加反应的甲烷质量为_________g,产物中CO与CO![]() 的质量比为__________。
的质量比为__________。
(6)煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,以前人们把煤粉加工成略大于乒乓球的球体,后来人们把煤粉加工成圆柱体,并在圆柱体内打一些孔(如图)。

①请你分析这种变化的优点是:______________________________
②煤在燃烧时会产生许多污染物,为了减少煤燃烧时对环境的污染,可设法把煤转化成清洁的燃料。将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H![]() ),请你写出该反应的化学方程式________________。
),请你写出该反应的化学方程式________________。
(7)某火力发电厂以煤碳为燃料,充分燃烧后将热能转化为电能,其排出的废气中含有CO![]() 、SO
、SO![]() 、水蒸气等。已知SO
、水蒸气等。已知SO![]() 既能使品红溶液褪色,又能使澄清石灰水变浑浊。因SO
既能使品红溶液褪色,又能使澄清石灰水变浑浊。因SO![]() 有还原性,故还能被高锰酸钾溶液氧化而除去,为了检验该发电厂排出的废气中的成分,用如下装置进行实验。
有还原性,故还能被高锰酸钾溶液氧化而除去,为了检验该发电厂排出的废气中的成分,用如下装置进行实验。
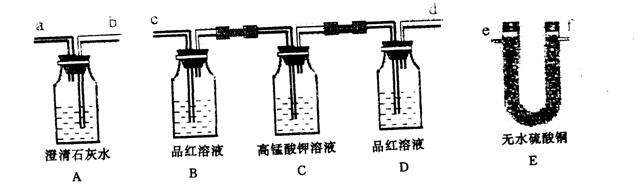
①仪器连接的顺序为(填导管接口字母)________________。
②根据______________现象证明SO![]() 存在。
存在。
③根据________________中无明显变化和装置A中________现象证明有CO![]() 存在。
存在。
④把装置E放置在最后,能否证明该废气中含有水蒸气?理由是___________。
⑤有人建议增高废气排放的烟,以此来降低附近的二氧化硫含量,你认为这样的做法可取吗?为什么?
____________________________________________________
根据课本上的二氧化碳循环示意图回答以下问题:
(8)绿色植物可以通过________________作用吸收CO![]() ,可以通过________作用将CO
,可以通过________作用将CO![]() 释放到大气中。
释放到大气中。
(9)人类活动可经由多种途径增加大气中CO![]() 的浓度,请写出下列①②③产生CO
的浓度,请写出下列①②③产生CO![]() 的化学方程式,并再举一例完成化学方程式。
的化学方程式,并再举一例完成化学方程式。
①石灰窑生产石灰:_____________________________________;
②煤炭燃烧:___________________________________________;
③液化石油气(以C![]() H
H![]() 为例)的燃烧:___________________________;
为例)的燃烧:___________________________;
④______________________________________________;
(10)若以CO![]() 为主的一些气体在大气中的积聚造成温室效应,那么由于_____________将会导致海平面上升。
为主的一些气体在大气中的积聚造成温室效应,那么由于_____________将会导致海平面上升。
(11)联合国气侯变化框架公约《京都议定书》要求发达国家限制二氧化碳等温室气体排放量,以控制日趋严重的温室效应。为减缓大气中CO![]() 含量的增加,以下建议可行的是(填序号)__________________。
含量的增加,以下建议可行的是(填序号)__________________。
①开发太阳能、水能、风能、地热等新能源; ②禁止使用煤、石油、天然气等矿物然料;
③大量植树造林,禁止乱砍滥伐。
六、关于质量守恒定律的探究过程:
31.(1)2400多年前,古希腊哲学家德谟克利特在一首诗中表达了物质不灭的观点:“无中不能生有,任何存在的东西也不会消灭。看起来万物是死了,但是实则犹生:正如一场春雨落地,霎时失去踪影;可是草木把它吸收,长成花叶果实,—依然欣欣向荣。”请你从分子和原子的观点,说明物质不灭的原因。
(2)1673年,英国化学有波义耳曾做过一个实验在密闭的玻璃容器中燃烧金属时,得到了金属灰,然后称量金属灰的质量,发现比原金属质量增加了。
1774年,拉瓦锡将45份质量重的氧化汞加热分解恰好得到41.5份质量的汞和3.5份质量的氧气,通过这个实验,他提出:在化学反应中,物质的总质量在反应前后保持不变,即质量守恒定律。
①试解释金属灰质量比原金属质量增加的原因。
②由于波义耳称量方法上的原因,他错过了发现质量守恒定律的机会。请你改进它的称量方法,以验证质量守恒定律。
(3)小明设计了一个实验来验证质量守恒定律。如右图所示,反应前天平平衡,他取下此装置(装置气密性良好)将其倾斜,使稀盐酸与大理石接触,待充分反应后,气球膨胀,再将装置放回天平左盘,此时他发现天平的指针向右偏转了。
请问:①这一现象是否遵守质量守恒定律?为什么?
②写出有关反应的化学方程式。
(4)小新用在空气中燃烧镁带的实验来探究质量守恒定律:
①镁带燃烧的化学方程式为_____________________。
②完全燃烧后,称量留下固体的质量比反应前镁带的质量还轻,联系实验过程分析,其原因可能有:____________________;_________________。
(5)依据质量守恒定律的内容,请回答:
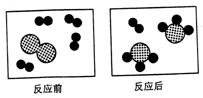
![]()
![]() ①下图形象地表示某反应前后反应物与生成物分子及其数目的变化,其中
分别
表示A、B、C三种不同的分子。该反应的化学方程式中A、B、C前的
①下图形象地表示某反应前后反应物与生成物分子及其数目的变化,其中
分别
表示A、B、C三种不同的分子。该反应的化学方程式中A、B、C前的
化学计量数之比为______________。
②把10g铁粉和铜粉的混合物放到盛有足量稀硫酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前金属混合物与稀硫酸的总质量减少了0.1g,求原金属混合物中铁的质量分数。(铜不与稀硫酸发生反应。Fe+H![]() SO
SO![]() =FeSO
=FeSO![]() H
H![]() ↑)
↑)
七、对过氧化氢分解产物的探究。
32.过氧化氢(H![]() O
O![]() )是医疗上常用的一种消毒液,常温时在二氧化锰作催化剂的条件下,可以发生分解反应,产生一种无色无味的气体。
)是医疗上常用的一种消毒液,常温时在二氧化锰作催化剂的条件下,可以发生分解反应,产生一种无色无味的气体。
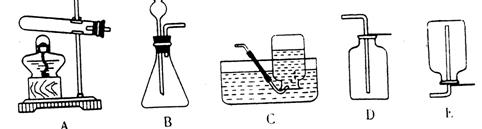
根据上述所给资料和装置,回答下列问题:
(1)若要在实验室制得这种气体,可选用的发生装置是_____________(填装置序号)。
(2)请你猜测,可能产生的气体是___________,你这样猜测的理由是______________。
(3)若要在实验室收集这种气体,一定要用_____________装置(请填装置序号)。
(4)请设计实验,验证你的猜测(简要叙述实验步骤、现象、结论)。
| 实验步骤 | 实验现象 | 实验结论 |
参考答案
一、1.A 2.B 3.B 4.A 5.B
6.C 7.C 8.D 9.B 10.C
二、11.C 12.D 13.A 14.A 15.B
三、16.B 17.BD 18.B 19.D 20.C
四、21.(1)
6
(2)7.73% (3)FeO, Fe![]() O
O![]() ,Fe
,Fe![]() O
O![]()
22.(1)NaCl (2)不会。在常温,密封放置情况下,该氯化钠溶液是稳定的。
![]()
![]()
![]()
![]()
![]() 23.(1)
(2)
23.(1)
(2)
(3)3Cl![]()
![]() (4)MnO
(4)MnO![]() MnO
MnO![]()
24.能溶解油脂,能溶解污物,不溶解纤维,不溶于水,易挥发,蒸气气密度比空气大等;不能灶烧,不支持燃烧,性质稳定,有毒,对臭氧层有破坏作用等。
25.(1)Fe, H![]() (2)CO
(2)CO![]() +Ca(OH)
+Ca(OH) ![]() =CaCO
=CaCO![]() ↓+H
↓+H![]() O
O
26.(1)30g (2)甲物质的溶解度随温度升高而显著增大;乙物质的溶解度随温度升高变化不大;
20℃时,甲,乙两种物质的溶解度相等……
27.①每2个水分子分解产生2个氢分子和1个氧分子 ②反应前后原子个数不变
③反应前后元素种类不变,都是氢,氧元素 ④反应前后各物质的质量不变。
28.(1)CO![]() +H
+H![]() O===H
O===H![]() CO
CO![]() (2)2H
(2)2H![]() O
O![]() 2H
2H![]() +O
+O![]() ↑
↑
(3)H![]() +CuO
+CuO![]() Cu+H
Cu+H![]() O (4)2KClO
O (4)2KClO![]()
![]() 2KCl+3O
2KCl+3O![]() ↑(答案开放,合理答案即可)
↑(答案开放,合理答案即可)
29.(1)A 、D ①元素的最高正比合价等于原子最外层电子数 ②稀有气体元素的化合价为0
③金属元素的化合价一般为正价 ④非金属元素的化合价一般有多种的化合价
⑤非金属元素的最低负价在数值上等于8最外层电子数(答案开放,合理答案均可)
五、30.(1)2CO+O![]()
![]() 2CO
2CO![]() CH
CH![]() +2O
+2O![]()
![]() CO
CO![]() +2 H
+2 H![]() O
O
(2)CH![]() (3)增大 (4)不科学,因为CO难溶于水;保持空气流通
(3)增大 (4)不科学,因为CO难溶于水;保持空气流通
(5)2.8g, 28 :33 (6)①增大O![]() 接触面积 ②C+ H
接触面积 ②C+ H![]() O
O![]() CO+H
CO+H![]()
(7)①e f c d b a ②B瓶中品红溶液褪色 ③D,变浑浊
④不能,从其它溶液中带出水蒸气 ⑤不可取,排放SO![]() 的总量不变,扩大了污染的范围,治标不治本。
的总量不变,扩大了污染的范围,治标不治本。
(8)光合,呼吸 (9)①CaCO![]()
![]() CaO+CO
CaO+CO![]() ↑ ②C+O
↑ ②C+O![]()
![]() CO
CO![]()
③C![]() H
H![]() +5O
+5O![]()
![]() 3CO
3CO![]() +4H
+4H![]() O
④2CO+O
O
④2CO+O![]()
![]() 2CO
2CO![]()
(10)冰川融化,海水膨胀
六、31.(1)略 (2)①金属与氧气反应,结合了氧元素,质量增加
②称量玻璃容器内所有物质在反应前后的增加 (3)①遵守质量守恒定律,该实验中气球膨胀产生浮力,使天平不平衡,其反应前后的物质的总质量不变。
②CaCO![]() +2HCl==CaCl
+2HCl==CaCl![]() +CO
+CO![]() ↑+H
↑+H![]() O
O
(4)①2Mg+O![]()
![]() 2MgO
2MgO
②镁带燃烧时有一缕白烟向空气中扩散,造成氧化镁损失;镁带燃烧时夹镁带的钳锅钳上有一层白色粉末,此粉末为氧化镁,也是成MgO的损失…… (5)①3 :1:2 ②分步给分,56%
七.32(1)B (2)H![]() 或O
或O![]() ,反应前后原子的种类的数同不变,而H
,反应前后原子的种类的数同不变,而H![]() O
O![]() 中只含有H,O两种元素,且反应后只生成一种气体,因此,这种气体可能是H
中只含有H,O两种元素,且反应后只生成一种气体,因此,这种气体可能是H![]() ,O
,O![]() 中的一种。 (3)C (4)用排水法收集一瓶气体,将带大量的木条伸入集气瓶中,如果带大量的木条复位,则证明生成的气体是O
中的一种。 (3)C (4)用排水法收集一瓶气体,将带大量的木条伸入集气瓶中,如果带大量的木条复位,则证明生成的气体是O![]() ,如果带大量的木条不复位,则证明生成的气体为H
,如果带大量的木条不复位,则证明生成的气体为H![]() 。
。