初三化学期末考试试题
本试卷满分100分,时间90分钟
(相对原子质量:H-1 O-16 C-12 N-14 S-32 Al-27 Mg-24 Ca-40 Fe-56 Cu-64 Zn-65)
一、选择题(每题只有一个正确答案。本题共22个小题,每小题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
1、判断物质的变化是物理变化还是化学变化的主要依据是( )
A、有无状态变化 B、有无发光发热现象
C、有无新物质生成 D、有无颜色变化
2、下列物质属于纯净物的是( )
A、天然气 B、石油 C、煤 D、水
3、物质的性质决定了物质的用途。下列物质的用途,既利用了物质的物理性质又利用了物质的化学性质的是( )
A、氢气用于充灌探空气球 B、二氧化碳用于灭火
C、一氧化碳用作民用燃料 D、氧气用于炼钢
4、“干冰”常用于贮藏食品和人工降雨,保持干冰化学性质的最小粒子是( )
A、二氧化碳分子 B、碳原子和氧原子
C、氢分子和氧分子 D、水分子
5、早在十九世纪70年代,俄国化学家罗蒙诺索夫就发现:在化学反应前后,各物质的质量总和相等。那么,质量总和相等的根本原因是( )
A、物质种类没有改变 B、分子种类和数目没有改变
C、元素种类没有改变 D、原子种类和数目没有改变
6、“臭氧空洞”和臭氧层变薄已越来越引起世界范围内科学家的重视和关注。已知臭氧的化学式是O3,下列有关其说法不正确的是( )
A、臭氧是由氧元素组成 B、臭氧是纯净物
C、每个臭氧分子由三个氧原子构成 D、臭氧转化为氧气不属于化学变化
7、我国古代的四大发明闻名于世。其中黑火药的爆炸的原理可以用下式表示:
S + 2KNO3 + 3C == K2S + N2↑+ 3X↑,则X的化学式是( )
A、CO B、SO2 C、NO D、CO2
8、下列物质(或其主要成分)的名称与其化学式不相符的是( )
A、醋酸(CH3COOH) B、赤铁矿(Fe3O4)
C、酒精(C2H5OH) D、大理石(CaCO3)
9、下列有关环境问题的认识中错误的是 ( )
A.大量使用塑料制品会产生白色垃圾 B.大量燃烧矿物燃料会导致“温室效应”
C.机动车尾气的排放不会污染大气 D.植树造林有利于遏制沙尘暴的发生
众所周知:吸烟有害健康,世界卫生组织将每年的5月21日定为“世界无烟日”。请完成下列有关的第10~12题:
10、香烟烟气中含有一种能与人体血液中的血红蛋白相结合的有毒气体是( )
A、CO2 B、CO C、N2 D、CH4
11、烟气不仅有毒,而且气味熏人,尤其是在门窗紧闭的空调房间之中。为消除或减少烟味,常在房间内点燃一支蜡烛,这是利用 ( )
A、石蜡的可燃性 B、二氧化碳比空气重
C、炭的吸附性 D、一氧化碳的还原性
12、香烟中还含有一种化学式为C10H14N2的致癌物质——尼古丁,下列有关尼古丁的说法错误的是( )
A、尼古丁的相对分子质量是162
![]() B、尼古丁中碳、氢、氮三种元素的质量比为10∶14∶2
B、尼古丁中碳、氢、氮三种元素的质量比为10∶14∶2
C、该分子中含有26个原子
D、尼古丁中氮元素的质量分数约为17.3%
13、如图所示,将一实心铁球系于弹簧秤上。几分钟后
弹簧秤的读数变大,则烧杯中所盛的液体是( )
A、稀硫酸 B、氯化铜溶液
C、稀盐酸 D、硫酸亚铁溶液
14、溶液在工农业生产和人们的日常生活中有着极其广泛的用途。下列有关溶液的叙述中正确的是( )
A、均一、稳定、无色、透明的液体一定都是溶液
B、饱和溶液中溶质质量分数一定大于不饱和溶液中该溶质的质量分数
C、固体的溶解度一定随溶剂质量的增大而增大
D、析出硝酸钾晶体后的溶液一定是该温度下硝酸钾的饱和溶液
15、按照加水溶解、过滤、蒸发的顺序进行的操作,可以分离的一组混合物是( )
A、氧化铜和木炭粉 B、混有泥沙的粗盐
C、硝酸钾和氯化钠 D、碳酸钙和二氧化锰
16、在下列条件下,试管中的铁钉最易生锈的是( )
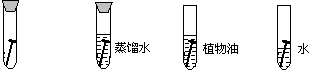 |
A B C D
17、农业生产中,有时用10%~20%的氯化钠溶液来选种。现用一定质量的饱和氯化钠溶液加水稀释来配制10%的氯化钠溶液,则在此稀释过程中保持不变的是( )
A、溶质的质量 B、溶剂的质量 C、溶液的质量 D、溶液的体积
18、20℃时硝酸钾的溶解度是31.6 g,则表明( )
A、20℃时100g水中最多可溶解硝酸钾固体31.6g,且不能溶解其它任何物质
B、20℃时,31.6g硝酸钾只能溶解在100g水中
C、20℃时100g硝酸钾饱和溶液中最多含有硝酸钾溶质31.6g
D、该温度下在200g水中可以溶解60g硝酸钾固体
19、“垃圾是放错了位置的资源”,应该分类回收。那么,下列可以和生活中废弃的铁锅、铝质易拉罐、废旧自行车钢圈等归为一类加以回收的是( )
A、废弃的铜导线 B、废塑料制品 C、旧的书报 D、废玻璃瓶
20、20℃时将5g Ca(OH)2固体加到95g水中,充分搅拌后静置,得到Ca(OH)2溶液,则溶液中溶质的质量分数为( )
A、5% B、10% C、2% D、小于1%
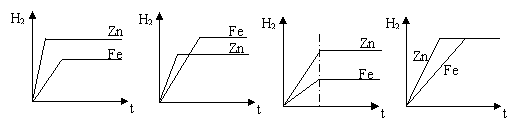 21、等质量的锌和铁分别与足量的稀硫酸反应,能正确表示生成氢气的质量(纵坐标)与反应时间t(横坐标)的关系的图象是( )
21、等质量的锌和铁分别与足量的稀硫酸反应,能正确表示生成氢气的质量(纵坐标)与反应时间t(横坐标)的关系的图象是( )
A B C D
22、用氯化钠的固体配制溶质的质量分数为5%的氯化钠溶液,必须使用的一组仪器是:①托盘天平②烧杯③玻璃棒④蒸发皿⑤量筒⑥水槽⑦集气瓶⑧铁架台⑨漏斗( )
A、①②③④ B、①②⑥⑦ C、①②③⑤ D、①②⑧⑨
二、填空题(每空1分,共34分)
23、用化学符号表示:
(1)+3价的铝元素____________ (2)镁离子__________________
(3)两个磷原子_______________ (4)4个二氧化硫分子____________
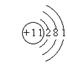 24、 左图是某元素原子的结构示意图,则该元素原子核内有 个质子,它属于 元素(类型),在化学反应中易 (填“得”、“失”)电子形
24、 左图是某元素原子的结构示意图,则该元素原子核内有 个质子,它属于 元素(类型),在化学反应中易 (填“得”、“失”)电子形
成 离子(填“阴”或“阳”),由该元素原子形成的离子符号是 。
25、在氢气、氧气、二氧化碳、一氧化碳和甲烷等五种气体中,能使灼热氧化铜还原为铜的气体单质是(以下各空均填化学式) ,点燃后只能生成使澄清石灰水变浑浊的气体的是 ,能使带火星木条复燃的是 ,只能用向上排空气法收集的气体是 ,属于有机物的是 。
 26、碘(I)元素对预防人体的甲状腺肿大(俗称“大脖子病”)有着不可替代的作用。右框图是我市某大型超市出售的“淮牌”加碘盐的部分文字说明:
26、碘(I)元素对预防人体的甲状腺肿大(俗称“大脖子病”)有着不可替代的作用。右框图是我市某大型超市出售的“淮牌”加碘盐的部分文字说明:
试回答:⑴已知碘酸钾的化学式为KIO3,其中碘元素的化合价为 ;
⑵含碘量中的“碘”是指(填序号) ;
①碘元素 ②碘原子 ③碘分子 ④碘离子
⑶从食用方法和贮藏指南中可以推断出碘酸钾的化学性质之一是 。
27、早在西汉刘安所著的《淮南万毕术》中就记载:曾青得铁则化为铜。写出这一变化的化学方程式: (这里“曾青”指硫酸铜溶液)。该反应是现代湿法冶金的先驱,与之相对应的是干法炼铜,试以氧化铜为原料,用一个相同基本类型的反应加以说明: 。
28、氨气(NH3)是工业制氮肥的主要原料。通常状况下,氨气是一种无色气体,极易溶于水,比空气轻。实验室用加热氯化铵和熟石灰固体混合物的方法来制取氨气。现有(1)制H2(2)制O2(3)制CO2 等三种气体的发生装置,则制备氨气应采用类似 的装置(填序号),收集氨气只能用 法,这是因为氨气 ;集满氨气的集气瓶应 (填“正”、“倒”)放在桌上,这是因为 。
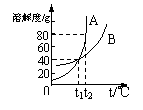 29、右图是A、B两种物质的溶解度曲线,据图回答:
29、右图是A、B两种物质的溶解度曲线,据图回答:
①在t2℃时,A的溶解度为 ;
②在t1℃时,B物质饱和溶液的溶质质量分数为 ;
③在 ℃时,两物质的溶解度相等;
④当温度低于t1℃时,A的溶解度 B的溶解度(填“>”、“=”或“<”)。
30、美国对伊拉克发动“武装倒萨”迫在眉睫,据报道:美国仍将采用对南联盟进行轰炸的“石墨炸弹”,以摧毁伊拉克的电力设备。这种炸弹在爆炸时能产生大量的纤维状的石墨,覆盖在发电厂的供电设备上,因为石墨具有 性,就会造成供电设备的短路而停电。日常用品中石墨用作 也是利用了这一性质。
31、长期盛放石灰水的瓶壁上常会出现一层白色固体,此固体是 (写化学式),出现这种现象的原因可用下列反应式表示: ,要清洗这种白色固体可先用 清洗,再用水冲洗。
32、将5g含氧元素64%的一氧化碳和二氧化碳的混合气体通过灼热的氧化铜,充分反应后的气体通入澄清石灰水中,最多可得到白色沉淀 g。
三、实验题(每空1分,共14分)
 33、实验室制备一氧化碳气体常用草酸(H2C2O4)在浓硫酸存在时发生如下反应
33、实验室制备一氧化碳气体常用草酸(H2C2O4)在浓硫酸存在时发生如下反应
H2C2O4 ===== CO2 ↑+ CO↑+ H2O
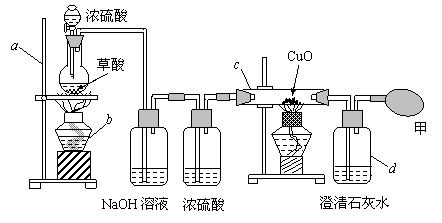 现欲制备纯净、干燥的一氧化碳气体,并验证其还原性,有如下装置,阅读后完成下列各题:
现欲制备纯净、干燥的一氧化碳气体,并验证其还原性,有如下装置,阅读后完成下列各题:
(1)写出仪器名称:
a b c d
(2)装置中NaOH溶液的作用是 ;
(3)为了得到干燥的一氧化碳气体,常用浓硫酸除去水蒸气。那么在气体发生装置中分液漏斗里的浓硫酸的作用是 ;
(4)证明一氧化碳具有还原性的两个实验现象是 、
;
(5)在甲处使用一个气球的目的是什么? ,
实现此目的还可以代用的措施是 。
34、蛋糕等食品包装中的除氧剂是一种黑色粉末状的固体,失效后带有红褐色。某化学课外兴趣小组为了探究其主要成分,将一包未变质的除氧剂分成两份:一份加入稀盐酸中,发现有大量气泡产生;另一份加入到氯化铜溶液中,一段时间后溶液的颜色变淡,固体逐渐变红。请回答:
(1)该除氧剂的主要成分是 ;
(2)为了验证上述推断是否正确,可以用到一种物理方法,即 ;
(3)下列有关说法不正确的有( )
A、凡是能与氧气反应的固体物质均可作为食品的除氧剂
B、该除氧剂不可用于牛奶、果汁等饮料的保鲜
C、米饭、蛋糕等食品的腐败变质属于缓慢氧化
D、干冰贮藏食物也是为了隔绝空气中的氧气
四、计算题(3分+5分,本题共8分)
35、实验室制备氢气一般用锌与20%的稀硫酸反应。现有98%(密度为1.84g/cm3)的浓硫酸,欲配制100g 20%的稀硫酸时,需要浓硫酸和水的体积各是多少毫升?
36、16.2g黄铜(一种铜和锌的合金)粉末与309.4g稀硫酸恰好完全反应,放出0.4g气体。求:(1)黄铜中铜的质量;(2)反应后所得溶液中溶质的质量分数。
参考答案
一、每选对一题得2分,否则不得分,共题总分44分。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | C | D | B | A | D | D | D | B | C | B | C |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B | B | D | B | D | A | D | A | D | B | C |
二、本题共34空,每填对一空得一分,共34分。
23、⑴![]() ⑵
⑵![]() ⑶2P ⑷4SO2 24、11,金属,失,阳,Na+
⑶2P ⑷4SO2 24、11,金属,失,阳,Na+
|
|
27、Fe+CuSO4==FeSO4+Cu ,H2+CuO====Cu+H2O或C+2CuO=====2Cu+CO2↑ 28、(2),排水集气法,极易溶于水,上,比空气轻 29、80g,28.6%,t1,<
30、导电,电极 31、CaCO3 ,Ca(OH)2+CO2=CaCO3↓+H2O,HCl(稀盐酸)
32、15g
三、实验题(每空1分,共14分)
33、⑴ a铁架台 b酒精灯 c玻璃管 d广口瓶 ⑵ 吸收(或除去)混合气体中的二氧化碳气体 ⑶ 催化剂 ⑷ 黑色固体变红,澄清石灰水变浑 ⑸ 收集多余的一氧化碳防止污染空气,点燃等
34、⑴铁 ⑵用磁铁吸引 ⑶ A ,D
四、计算题(共8分,3分+ 5分)
35、解:浓硫酸体积=100g×20%÷(1.84g/cm3×98%)=11.1 cm3 (2分)
水的体积=(100g —11.1 cm3×1.84g/cm3)÷1g/cm3 = 79.6 cm3 (1分)
答:需要浓硫酸11.1毫升,水79.6毫升。
36、解:设黄铜中锌的质量为x,反应生成ZnSO4的质量为y
Zn + H2SO4 === ZnSO4 + H2↑ (1分)
65 161 2
x y 0.4g
![]() x =
13g
x =
13g ![]() y =
32.2g (2分)
y =
32.2g (2分)
(1) 黄铜中铜的质量= 16.2g - 13g = 3.2 g (1分)
(2) 反应后硫酸锌溶液中溶质的质量分数为
![]() 10%
(1分)
10%
(1分)
答:(1)黄铜中铜的质量为 3.2 g;(2)反应后所得溶液中溶质质量分数为10%。