![]()
|
|
学科:化学 |
| 教学内容:初三化学化合价 |
【基础知识精讲】
一、化合价
1.定义:一种元素一定数目的原子跟其它元素一定数目的原子化合的性质,叫这种元素的化合价.有正价、负价之分,用+1,+2,-1,-2……表示,标在元素符号的正上方,如:![]() 、
、![]() 、
、![]() 等.
等.
2.确定
①在离子化合物中,化合价的数值就是一个原子得失电子的数目,失电子的原子为正价,得电子的原子为负价.
②在共价化合物中,化合价的数值就是一个原子跟其它元素的原子形成共用电子对的数目,电子对偏离的原子为正价,电子对偏向的原子为负价.
3.元素化合价的规律
①化合价原则:在化合物里,元素正负化合价的代数和为零.
②单质中元素化合价为零.
③化合物里,氢元素通常显+1价,氧元素通常显-2价,金属元素通常显正价,非金属元素跟金属元素或氢元素化合时通常显负价.
④许多元素具有可变化合价,例:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() .
.
⑤原子团的化合价由构成元素原子的正负化合价的代数和算出.根的化合价一定不为零.例如:![]() 、
、![]() .
.
⑥熟记常见元素和原子团的化合价
钾K钠Na银Ag氢H+1价;铜Cu+1,+2,铝Al+3
钙Ca镁Mg钡Ba锌Zn+2价;铁Fe+2,+3,硅Si+4
氟F氯Cl溴Br碘I-1价;碳C有+2,+4
通常氧O为-2价,硫S有-2,+4, +6
氢氧根OH-1价,硝酸根NO3-1价,铵根NH4+1价,硫酸根SO4-2价,碳酸根CO3-2价.
二、化合价规律的应用
1.根据化合价原则,书写化合物的化学式
书写口诀:正在前,负在后;标价数,化简价交叉,检验为零.
2.根据化合价原则,计算未知元素的化合价.
【重点难点解析】
一、化合价实质的理解:就是元素的一个原子在与其它元素原子化合时得失电子数目或形成共用电子对的数目,它的数目与原子的最外层电子数目有密切关系.
二、同一元素在不同化合物中或同一化合物中可以具有不同的化合价.如:![]() (氯化铁)
(氯化铁)![]() (氯化亚铁)
(氯化亚铁) ![]() (氧化铜)
(氧化铜) ![]() (氧化亚铜)
(氧化亚铜) ![]() (硝酸铵)
(硝酸铵)
三、注意化合价符号与离子符号的不同
元素化合价标在元素符号正上方,写上±a,如:![]()
![]() (1不省略),离子符号中的电荷数写在元素符号右上方,写a±,如钙离子Ca2+,氯离子Cl-(1省略)
(1不省略),离子符号中的电荷数写在元素符号右上方,写a±,如钙离子Ca2+,氯离子Cl-(1省略)
例1 指出下列符号中,数字“3”所表示的意义
3Al Al3+ ![]() NH3
3H2O
NH3
3H2O
分析 化学用语中各种数字所代表的意义,主要有以下几种:①粒子前面的数字,表示粒子的数目;②粒子中元素符号右下方数字表示粒子中某元素原子个数或原子团个数;③粒子右上方数字表示粒子(离子、原子核等)所带的电荷数;④粒子符号正上方的数字表示元素或原子团的化合价.
解答 3个铝原子;1个铝离子带3个单位正电荷;铝元素化合价为+3价;1个氨分子含有3个氢原子;3个水分子.
例2 在某种共价化合物中,M元素显-2价,这是由于( )
A.1个M原子得到2个电子
B.1个M原子得到2对电子
C.2个共用电对偏离M原子
D.2个共用电子对偏向M原子
分析 “-”即负价,在共价化合物中表示共用电子对偏向的原子的化合价,而在离子化合物中负价表示得到电子的原子的化合价。
解答 选D
例3 ①书写硫酸铝的化学式;②计算H2SO3中S的化合价;③判断碳酸钾( KCO3)的化学式是否正确.
解答 ①![]()
![]() →
→![]() 3
(+3)×2+(-2)×3=0
3
(+3)×2+(-2)×3=0
②![]() (+1)×2+x+(-2) ×3=0 ∴x=+4
(+1)×2+x+(-2) ×3=0 ∴x=+4
③![]() (+1)+(-2)=-1≠0
∴化学式出错.
(+1)+(-2)=-1≠0
∴化学式出错.
正确化学式为K2CO3
【难题巧解点拨】
例1 氯化钠与氯化氢中氯元素均呈-1价,其实质有何不同?
分析 氯化钠是离子化合物,离子化合物在形成过程中是原子得失电子后形成阴、阳离子,即钠原子失去一个电子成为Na+,显+1价,氯原子得一个电子成为Cl-,显-1价;氯化氢是共价化合物,共价化合物在形成过程中原子以共用电子对结合在一起形成分子,共用电子对偏移程度不同使元素呈正负价.在氯化氢分子中,氯原子吸引电子能力较强,共用电子对偏向氯原子,使其呈-1价,共用电子对偏离氢原子,使其是+1价.
解答 氯化钠中,每个氯原子得到一个电子,形成带一个单位负电荷的Cl-,使其呈-1价.氯化氢中,氢原子与氯原子形成的一对共用电子对偏向氯原子而使其呈-1价.
例2 已知X原子的最外层电子数为4,Y原子的最外层电子数为6,它们互相形成化合物时,其化学式可能为( )
A.XY B.XY2 C.YX3 D.X2Y
解答 根据1~18号原子核外电子排布的特点,可以推测X可能为C或Si;Y可能是O或S,所以它们互相形成化合物的化学式可能为CO2 1∶2型或CO 1∶1型,故选(A)B.
【典型热点考题】
例1 已知在X、Y两种元素形成的一种化合物中,X的化合价为+n,Y的化合价为-![]() ,且X与Y的质量比为7∶3,则X与Y的相对原子质量之比为( )
,且X与Y的质量比为7∶3,则X与Y的相对原子质量之比为( )
A.7∶4 B.2∶7 C.3∶7 D.7∶2
解答 ![]() →
→![]() Y
Y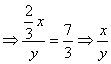 故选D
故选D
例2 分析HCl、X、HClO、KClO3、KclO4的排列顺序规律,可知 X代表的是( )
A.NaCl B.Ca(ClO)2 C.Cl2 D.Cl2O3
解答 ![]()
![]() K
K![]() O3 K
O3 K![]() O4 Na
O4 Na![]() Ca(
Ca(![]() )2
)2 ![]() 2
2 ![]()
显然,标出各物质中Cl的化合价,不难看出是按Cl元素化合价由低→高顺序排列,故选C.
例3 K2MnO4中锰元素的化合价是( )
A.-2价 B.+2价 C.+4价 D.+6价
解答 设Mn的化合价为x,则
(+1)×2+x+(-2)×4= 0 ∴x=+ 6选 D
例4 有一种氨的氧化物,其中氮、氧元素的质量比为7∶16,则此氮的氧化物中氮元素的化合价是( )
A.+1价 B.+5价 C.+3价 D.+4价
解答 设此氧化物化学式为 NxOy
依题意:![]() ∴
∴![]()
故化学式为![]() z+(-2)×2=0 ∴z=+4 选 D
z+(-2)×2=0 ∴z=+4 选 D

【同步达纲练习】
一、选择题(6×10=60分)
1.下列关于化合价的叙述:
①化合价是元素的一种性质,因此称为元素的化合价,而不应称为原子的化合价.
②化合价有正价和负价,其数值等于元素的原子得失电子的数目,
③一种元素只有一种化合价.
④在化合物中非金属元素的化合价为负值.
⑤在共价化合物中,元素的化合价的数值,就是它的一个原子与其他元素的原子形成共 用电子对的数目.其中正确的是( )
A①② B.①③⑤ C.②③④ D.①⑤
2.下列是 X、 Y两种元素的核电荷数,能形成 Y2X的是( )
A.12;17 B.8;1 C.8;11 D.9;13
3.在下列化合物中,具有+5价元素的是( )
A.P2O5 B.H2SO4 C.KMnO4 D.K2CO3
4.在下列化合物中,具有+1价原子团的是( )
A.Mg(OH)2 B.FeSO4 C.KCl D.(NH4)2CO3
5.下列化学式错误的是( )
A.SFe B.Al(OH)3 C.Mg(NO3)2 D.Fe2O3
6.X与Y两种元素,其原子量分别为24和14,它们互相形成化合物时,其化合价分别为+2和+3,则X、Y组成的化合物的式量是( )
A.38 B.90 C.100 D.无法计算
二、填空题(3×10=30分)
7.在形成NaCl的过程中,1个钠原子 个电子,带 个单位 电荷,所以钠元素为 价;1个氯原子 个电子,带 个单位 电荷,所以氯元素为_ 价.在HCl,1个氢原子和1个氢原子形成 对 ,且 偏离了 ,显 价; 偏向了 ,显 价.在所有化合物中,各元素正负化合价的代数和等于 ,在单质中的元素,其化合价为 .
8.用数字和化学符号表示
2个铜离子 ,3个硫酸根离子 ,4个亚铁离子 ,4个铁原子 ,铁元素的化合价为+3 ,3个二氧化硫分子 .
9.写出下列物质的化学式:
氧化铜 氧化铁 氧化亚铜 氯化钾
硫酸铝 氢氧化亚铁 氯化银 硝酸铜
碳酸钠 氯酸钾 高锰酸钾 锰酸钾
二氧化锰 硫酸 盐酸
三、推断题
10.A、B、C、D四种元素,A原子为质量最小的原子,B原子得到1个电子后与氩原子的电子层结构相同;C元素的阳离子与D元素的阴离子核电荷数相差3;D元素为地壳中含量最多的元素.则A.B、C、D四种元素两两组成的化合物为离子化合物的是(写化学式) 、 .为共价化合物的是(写化学式) 、 .
【素质优化训练】
1.某化合物的化学式为Ca(H2RO4)2,则元素R的化合价是多少?写出该元素以相同化合价形成的氧化物的化学式.
2.下列说法正确的是( )
A.元素的化合价数值等于一个原子得失电子的数目
B.铁的化合价为零
C.水中氢气的化合价为零
D.单质铜中铜元素化合价为零,化合物中铜元素化合价为+1或+2价
3.X、Y、Z三种元素组成的化合物里,Y为+2价,X为+5价,Z为-2价.X、Z两元素在化合物里组成的原子团为-3价,且有5个原子.则此化合物的化学式为 .

参考答案:
【同步达纲练习】
一、1.D 2.BC 3.A 4.D 5.A 6.C
二、7.失去1,1,正, +1,得到1,1,负,-1,1 共用电子对,电子对,氢+1,电子对氯-1,零、零、 8.2Cu2+、3SO2-4、4Fe2+、4Fe、![]() 、3SO2 9.CuO、Fe2O3、Cu2O、KCl、Al2(SO4)3、Fe(OH)2、AgCl、Cu(NO3)2、Na2CO3、KClO3、KMnO4、K2MnO4、MnO2、H2SO4、HCl 10.NaCl、Na2O;HCl H2O
、3SO2 9.CuO、Fe2O3、Cu2O、KCl、Al2(SO4)3、Fe(OH)2、AgCl、Cu(NO3)2、Na2CO3、KClO3、KMnO4、K2MnO4、MnO2、H2SO4、HCl 10.NaCl、Na2O;HCl H2O
【素质优化训练】
1.+5;R2O5 2.D 3.Y3(XZ4)2
