初三化学计算
【知识点拨】
一.根据化学式计算
1.原理:抓住化学式的概念,理解化学式中各符号、数字的涵义,处理好部分与整体之间的求算关系。
2.类型:①计算相对分子质量,元素质量比或元素的质量分数
②根据相对分子质量,元素质量比或元素的质量分数求化学式
③求一定质量纯净物中含某元素的质量以及逆运算
④根据样品中某元素的实际含量求样品的纯度
⑤不同物质中含等量同一元素的计算
(某元素的原子个数相同)
⑥求等量的不同物质中含同一元素的质量比
3.方法:①公式法:相对分子质量=化学式中各原子的相对原子质量总和
元素的质量比=化学式中各元素相对原子质量总和之比
![]()
物质的纯度=(某元素实际含量÷某元素理论含量)×100%
②方程法:根据不同物质所含某成分的量相等列方程式计算
③关系式法:从化学式中找某一元素的原子含量关系列式计算
④估算推理法:通过分析推理或简单的心算,口算快速求解
4.中考热点分析:
热点(1):相对分子质量的求算。此类计算作为传播最新科技,最新发现或普及健康知识等内容的载体。
热点(2):化合物中元素质量比的求算。
5.解题方法:化学计算题具有知识覆盖面大,题型变化多,综合性强,解法灵活讲究技巧性等特点,常作为中考的选拔性题目。复习化学计算时,一要重视补基础:切实掌握好基本概念,基本原理,基本性质,基本计算等基础知识;二要注意补思维缺陷:训练思维的逻辑性,深刻性,敏捷性,灵活性和发散性;三要注意补能力缺陷:培养自学能力,类比分析能力,知识迁移能力,总结规律的能力,文字表达能力等。此外,还必须掌握解题技巧,要举一反三,对典型题进行一题多解或一解多题的训练,从中找出解决问题的最佳方法或共同方法。因此,根据化学式的计算复习时要注意以下几个问题:
①正确理解化学式的概念:对化学式前及化学式中数字的含义理解正确,避免相对分子质量、元素质量比或质量分数计算的根本性错误,导致化学方程式计算的连环性失分。
②要用化学原理加数学手段指导化学计算的解题过程,切不可将化学计算理解为单纯的数学问题。要能训练运用化学式与化合价,原子个数比和元素质量比或质量分数之间的内在联系进行综合计算。
③掌握有关化学式的解题技巧,在掌握基本计算的基础上,探索一些能使计算简化的特殊解法。例如比较组成有相似之处的物质中某一成分的含量,可用估算推理法;根据物质中某元素的实际含量,可巧用极限法推测其中所含的杂质成分;根据混合物中各物质的组成巧合,计算元素质量分数等。
二.根据化学方程式的计算
1.计算原理:化学反应中质量守恒,反应物与生成物各物质之间存在着最基本的比例关系
2.计算类型:
①以代数式表示化学方程式的计算
②反应物,生成物均为纯净物的计算
③有关不纯物质的计算
④多步反应计算
⑤缺数据或多数计算
⑥信息给予计算
⑦化学方程式与溶质质量分数的综合计算
3.解题步骤:
①根据题意设未知
②写出正确的化学方程式
③找出已知物和待求物之间的质量比
④代入纯净的已知和未知物质量
⑤列正比例式求出未知
⑥简答
4.常用换算公式:
①纯净物质量=不纯物质量×物质的质量分数
②纯净物质量=纯净物的体积×密度
③溶质质量=溶液质量×溶质的质量分数
5.计算技能和技巧:
①方程式或方程组法
②守恒法或差量法
③讨论法或估算法
6.思维模式(步骤)
①认真阅读,挖掘题示信息
②灵活组合,应用基础知识
③思维判断,并借助数学计算得出结论
7.中考热点分析:
①依据常见反应的化学方程式进行简单的反应物,生成物的质量求算,对学生进行基础知识的考查
②通过解题时应用的化学原理和数学抽象,简捷的文字表达,考查思维的敏捷性,严密性,整体性,发散性和创造性。此类题型有:
A 不明反应物和生成物的纯净物质量,必须利用化学反应中元素或物质质量的守恒才能切入的计算
B 利用极限估算法判断参加反应的混合物组成的计算
C 含一定量不参加化学反应的杂质的反应物或生成物的计算
D 根据化学反应前后某一成分质量的相等,计算相关物质之间的质量比的无数据或缺数据计算
E 有关天平平衡的计算
F 有关反应曲线的计算分析
G 计算反应前或反应后某溶液的溶质质量分数
以上题目如出现在填空,选择题型中,一般是已知一种纯净物质量或用估算法就能解答的题目,计算过程都较简捷;如出现在计算题中则可简单可复杂,但多与溶液计算综合出现,成为中考的压轴题
8.解题方法
根据化学方程式的计算题型繁多,复习和解题时要注意以下几个问题:
①要训练掌握常见反应的化学方程式,注意配平
②代入化学方程式中的各物质的量应该是纯净的质量,若不纯应乘以质量分数后代入,体积要乘以密度代入
③要正确理解化学方程式的含义,善于利用质量守恒定律去发现或明确或隐含条件。例如:利用反应前后某一物质质量的相等作为解题的突破口,巧设数据化抽象为形象解答缺数据或无数据计算题等。
④要掌握一些特殊的计算技巧,复习时有针对性地归类加以强化训练。
⑤重视理论联系实际的计算型训练,这是中考命题的新趋势
三、有关溶液的计算
1、有关溶液的计算要求达到掌握,掌握:即能够“应用”。能够分析知识的联系和区别,能够综合运用知识解决问题。包括:根据溶解度概念的计算,掌握温度、溶剂条件都不改变的计算。根据溶液的溶质质量分数的计算,要求掌握有关概念和加水稀释的计算。
2、考试要点:溶解度概念的计算,溶质质量分数的计算。如[练习部分]中的第1、2、4、6、9、13、14等题,考试热点:有关概念和加水稀释的计算,有关质量和体积的换算及根据化学方程式的综合计算等。如[练习部分]中的第3、5、8、10、11、15、16、17题。
【例题解析】
1.相同质量的CO和CO2中,碳元素的质量比是( )
A、7∶11 B、11∶7 C、1∶1 D、14∶11
思路:从化学式可看出在CO中只含一个氧原子,在CO2中含2个氧原子,显然CO中碳元素的含量要大于CO2中碳元素的含量,则A、C肯定不合理。但B、D究竟哪个合理,还要经过计算。
在质量相同时,实际上两种物质中碳元素的质量分数的比就是碳元素的质量比。
首先要计算相对分子质量,再计算碳元素的质量分数。
设CO和CO2的质量均为m
CO中碳的质量应为m·![]()
CO2中碳的质量应为m·![]()
质量比为![]() ∶
∶![]() =11∶7
=11∶7
解答:B。
2.某三价金属的氧化物中,该金属元素的质量分数为70%,该金属氧化物与稀硫酸完全反应所生成盐的相对分子质量为( )
A、56 B、160 C、320 D、400
思路:从题中给的+3价金属可写出其氧化物化学式,从其金属质量分数可求出该金属相对原子质量,从+3价还可写出其硫酸正盐的化学式(完全反应),即可算出其相对分子质量。
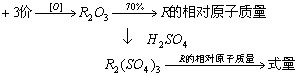
解答:D
3.将18.4g某化合物在空气中完全燃烧后,共得到26.4g二氧化碳和14.4g水。求:
(1)该化合物同哪几种元素组成?每种元素的质量分数各是多少?
(2)该化俣物中各元素的原子个数比是多少?若该化合物的相对分子质量是92,写出该化合物的化学式。
思路:化合物在空气中燃烧即与空气中的氧气反应,生成物为二氧化碳和水,二氧化碳中的碳元素和水中的氢元素都是原化合物成分,不是空气供给的;生成物的氧元素至少有一部分是空气供给,也可能全都是空气供给的。将二氧化碳中的碳元素质量与水中的氢元素质量之和与原燃烧的化合物相比,如果相等,说明原化合物是由碳、氢元素组成的;如果反应后生成物中所含碳、氢元素质量和小于原化合物质量,说明原化合物中除含有碳元素和氢元素外,还含有氧元素。
解答:26.4g×![]() =7.2g 碳元素质量
=7.2g 碳元素质量
14.4g×![]() =1.6g 氢元素质量
=1.6g 氢元素质量
18.4g-7.2g-1.6g=9.6g 氧元素质量
各元素质量分数分别为:
![]() ×100=39.1% (碳)
×100=39.1% (碳)
![]() ×100=8.7% (氢)
×100=8.7% (氢)
![]() ×100=52.2% (氧)
×100=52.2% (氧)
各元素原子个数比为:
![]() ∶
∶![]() ∶
∶![]() =3∶8∶3
=3∶8∶3
该化合物化学式为C3H8O3。
4.一定温度下,向某硝酸钾溶液中加入4g硝酸钾固体或蒸发掉20g水,都恰好使溶液达到饱和。则该温度下硝酸钾的溶解度为( )
A、20g B、16g C、8g D、4g
思路:该溶液在一定温度下恒温蒸20g后达到饱和,若把蒸发掉的20g水收集起来,则该溶液可看作是由这两部分混合而成;一部分是饱和溶液A,另一部分是20g水B。因为A已经是饱和溶液,在该温度下不能再溶解溶质,所以向该溶液中加入的4g硝酸钾固定实际上是被20g水B所溶解,而4g硝酸钾已使该溶液达到饱和,则结论是:在该温度下20g水中溶解4g硝酸钾固定即达到饱和。由此可计算出该温度的溶解度。
设该温度时KNO3的溶解度为x
![]() ,x=20g
,x=20g
解答:A
5.现有某温度下溶质的质量分数相同的两份硝酸钾溶液,它们的质量是100g。甲学生把其中一份溶液蒸发掉2.5g水后,恢复到原温度,析出2g晶体;乙学生把另一份溶液蒸发掉5g水后,恢复到原温度,析出4.5g晶体。该温度下硝酸钾的溶解度是__________。
思路:甲学生将溶液恒温蒸发2.5g水后有晶体析出,则无论析出晶体多少,所剩余的溶液一定是饱和溶液。
乙学生蒸发5g水的过程可分为两个阶段:先蒸发2.5g水,再接着蒸发2.5g水,则第一次蒸发2.5g水后,与甲学生蒸发2.5g水后,所剩溶液是相同的,都是饱和溶液。那么,第二次蒸发掉2.5g水时是将所剩的饱和溶液蒸发2.5g水。乙学生蒸发5g水析出的4.5g晶体也相应地分为两部分,即第一次蒸发2.5g水时应析出与甲学生操作中析出同样多的晶体,即2g,则乙学生第二次蒸发掉2.5g水时析出的晶体量应为(4.5g-2g)=2.5g。这就是说,在该温度时2.5g水中溶解2.5g硝酸钾刚好是饱和溶液。则其溶解度A应为
![]() ,A=100g
,A=100g
解答:100g
6.温度为t时有某固体的水溶液400g,恒温蒸发10g水后,有5g该固体结晶析出;滤出晶体,再恒温蒸发10g水后,又有10g该固体结晶析出。若将原溶液连续恒温蒸发水分,则能正确表示析出晶体质量与蒸发水分质量的关系的图是下列图中的( )
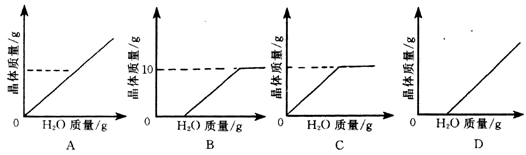
思路:根据例2和例3的分析,可以求出该物质在温度t时的溶解度A。
![]() ,A=100g
,A=100g
由溶解度可以求出该溶液蒸发掉多少克水后溶液刚好饱和。第一次蒸发10g水分析出5g晶体,由溶解度可算出该5g晶体若制成饱和溶液所需的水分m为:
![]() ,m=5g
,m=5g
则可知,该溶液原来为不饱和溶液,开始蒸发水分到5g时刚好达到饱和,因此,最先蒸发5g水时并无晶体析出,从蒸发5g水后再蒸发水分便开始析出晶体,以后每蒸发100g水便会有100g晶体析出。由此可确定正确的图应是D。
解答:D
7.有某种固体的20℃的水溶液720g,若将其蒸发掉80g水,恢复到20℃后,有10g该固体结晶析出;若向该溶液中加入60g该固体,充分溶解后过滤,得到未能溶解的该固体6g。求:
(1)20℃时该固体的溶解度是多少?
(2)原溶液中该固体的质量分数是多少?
思路:将原溶液分解成两部分:第一部分为80g水与10g溶质,第二部分为蒸发水后剩余的溶液,因为蒸发水后有晶体析出,所以剩余溶液(720g-80g-10g)=630g应为20℃的饱和溶液。
第一部分溶液由80g水和10g溶质组成,应为不饱和溶液。因为第二部分的630g溶液已经饱和,所以若加入溶质也不能再溶解,能溶解溶质的实际上只是第一部分的90g不饱和溶液,向其中加入(60g-6g)=54g溶质恰好饱和,由此可求出20℃时该固体的溶解度。根据溶解度可求出第二部分溶液中溶质质量,然后便可以求出原溶液的组成及溶质的质量分数。
解答:设该固体在20℃时溶解度为x,
蒸发80g水后剩余溶液中溶解的溶质质量为y,
![]()
x=80g
![]()
y=280g
原溶液中溶质质量分数为:
![]() ×100%=40.3%
×100%=40.3%
答:20℃时该固体的溶解度为80g,原溶液溶质质量分数为40.3%。
8.将Fe、Mg、Al分别放入稀盐酸中,反应结束后,放出的气体质量相同,其原因可能是( )
A、放入Fe、Mg、Al的质量相同,跟足量的盐酸反应
B、放入Fe、Mg、Al的质量比是28∶12∶9,跟足量的盐酸反应
C、放入Fe、Mg、Al的质量比是56∶24∶27,跟足量的盐酸反应
D、放入Fe、Mg、Al均过量,跟三种金属反应的盐酸的质量相同,质量分数也相同
思路:金属不同,与酸反应生成氢气的量相同,有三种可能:
①酸足量,反应结束时金属全部溶解,则反应的金属的质量比为:
MFe∶MMg∶MAl=![]() ∶
∶![]() ∶
∶![]()
②金属足量,酸全部反应,消耗酸的溶质质量相同,当酸的溶质质量分数也相同时,消耗酸的溶液质量也相同。
③若金属质量不同或酸的质量也不同,则情况很多,应具体计算。
9.某学生取一瓶稀硫酸,等体积分装在甲、乙两个烧杯中,再称取质量相等的镁带和锌粒,把镁带放入甲烧杯中,锌粒放入乙烧杯中,待反应结束后,发现甲烧杯中镁带有剩余,乙烧杯中锌粒已全部反应,根据实验现象推断,下列结论中,正确的是( )
A、甲烧杯中产生的氢气多
B、乙烧杯中产生的氢气多
C、甲、乙两烧杯中产生的氢气一样多
D、甲烧杯中产生的氢多或甲、乙两烧杯中产生的氢气一样多
思路:(1)若反应结束时,两烧杯中的酸全部反应完,则反应的酸的质量相等,生成氢气的质量一定相等;(2)若反应结束,乙烧杯中尚有剩余的酸存在,而在甲烧杯中酸必定完全反应(镁带有余),因此甲烧杯中产生的氢气一定比乙烧杯中产生的多。
解答:D
10.在已平衡的天平两边托盘上,各放一质量相同的烧杯,烧杯中分别盛有等质量、等质量分数的稀硫酸,向左边加入mg铁,向右边加入mg锌,当反应停止后,若天平仍保持平衡,则反应物中一定没有剩余的物质是__________,一定有剩余的物质是铁,可能有剩余的物质是______________。
思路:Zn、Fe与H2SO4的反应为:
Zn+H2SO4=ZnSO4+H2↑
65 98 2
Fe+H2SO4=FeSO4+H2↑
56 98 2
(1)若金属都过量,并都有剩余,H2SO4质量小于![]() m,H 2SO4全部反应,生成H2质量相等,天平仍平衡;
m,H 2SO4全部反应,生成H2质量相等,天平仍平衡;
(2)若金属质量与H2SO4质量比为65∶98,则Zn和H2SO4都完全反应,而Fe有剩余,此时生成H2质量相等,天平仍然平衡;
(3)若H2SO4质量大于![]() m,小于
m,小于![]() m,则Zn耗尽,铁剩余,右边烧杯(放入Zn)中的H2SO4有剩余,右边烧杯(放入Fe)中的H2SO4耗尽,生成H2质量不等,天平不平衡,右端向下;
m,则Zn耗尽,铁剩余,右边烧杯(放入Zn)中的H2SO4有剩余,右边烧杯(放入Fe)中的H2SO4耗尽,生成H2质量不等,天平不平衡,右端向下;
(4)若H2SO4质量等于![]() m,右边烧杯中Zn耗尽,酸有剩余,左边烧杯中的Fe和H2SO4刚好完全反应,左杯中生成H2多,天平不平衡,右端下降;
m,右边烧杯中Zn耗尽,酸有剩余,左边烧杯中的Fe和H2SO4刚好完全反应,左杯中生成H2多,天平不平衡,右端下降;
(5)若H2SO4质量大于![]() m,金属都耗尽,酸都有剩余,但在质量相同的Zn、Fe中,Fe生成的H2质量大,天平右端向下降。
m,金属都耗尽,酸都有剩余,但在质量相同的Zn、Fe中,Fe生成的H2质量大,天平右端向下降。
解答:H2SO4;Zn
【相关练习】
一、有关化学式的计算
一、选择题
1.常用作消毒剂的高锰酸钾(KMnO4)中锰元素的化合价是( ) 1.A
A.+7价 B.+6价 C.+5价 D.+4价
2.含0.1克氢元素的水质量是( ) 2.D
A.18克 B.1.8克 C.9克 D.0.9克
3.缺碘易使人患甲状腺亢进,因此在食盐中一般都加入碘酸钾这种物质。在碘酸钾中碘的化合价为+5价,则碘酸钾的化学式为( ) 3.C
A.KIO B.KIO2 C.KIO3 D.KIO4
4.某氧化物的化学式为RO3,其中氧元素的质量分数为60%,则R的相对原子质量是( ) 4.B
A.16 B.32 C.40 D.56
5.已知碳酸钙和另一物质组成的混合物中含碳质量分数大于12%,则另一物质可能是( )5.C
A.Na2CO3 B.KHCO3 C.MgCO3 D.K2CO3
6.某元素的氢化物分子式RH3,其最高价氧化物中,R与氧的质量比为7∶20,则R元素的相对原子质量是( ) 6.C
A.12 B.32 C.14 D.28
7.下列氮元素的氧化物中,所含氮元素与氧元素的质量比为7∶20的化合物的化学式是( )7.D
A.N2O B.NO2 C.N2O3 D.N2O5
8.下列物质中含氮的质量分数最大的是( )8.B
A.硝酸铵 B.尿素[CO(NH2)2] C.碳酸氢铵 D.硫酸铵
9.要使Fe2O3和Fe3O4中含有相同质量的铁元素,则这两种物质的质量比应该是( ) 9.C
A.3∶2 B.1∶1 C.30∶29 D.29∶42
10.A、B元素相对原子质量之比为2∶1。仅由这两种元素组成的化合物里,A、B元素的质量比为2∶3,其中B显一n价,则此化合物中A的化合价是( ) 10.B
A.+n B.+3n C.-n D.+2n
11.某+2价金属的氯化物,经测定知道含氯55.9%,该金属元素是( ) 11.D
A.Mg B.Ca C.Cu D.Fe
12.某金属元素R在氧化物里显+2价,其氧化物中R的质量分数为60%,则该氧化物的相对分子质量为( ) 12.B
A.113 B.40 C.54 D.40克
13.某元素R的+4价氧化物的相对分子质量为N,则R的相对原子质量是( )13.D
A.N+32 B.N-16 C.![]() D.N-32
D.N-32
14.某元素的氧化物相对分子质量为M1,其硫酸盐的相对分子质量为M2,则该元素的化合价可能是下列关系中的( ) 14.AC
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
二、填充题
15.吸烟对人体是有害的,其中肺里会吸入一种易溶于水的剧毒物质尼古丁,其化学式是C10H14N2,该物质的相对分子质量为________。15. 162
16.已知元素R的最高价氧化物的化学式为RO3,又知该元素的氢化物中氢元素的质量分数为5.88%,则R的相对原子质量为________________________________。16. 32
17.X与Y两种元素可组成不同化合物C1和C2,从表中两种化合物含X和Y的质量分数等项来确定C2的化学式。17. XY3
| 化合物 | X | Y | 化学式 |
| C1 | 50% | 50% | XY2 |
| C2 | 40% | 60% |
|
18.在含氮的五种氧化物NO、N2O、N2O3、NO2、N2O5中,含氮量最高的是_________________,其含氮量是______________%;含氮量最低的是_________,其含氮量是________%。
18. N2O;63.6%;N2O5;26%
三、计算题
19.列式计算下列各物质的相对分子质量或相对分子质量的总和:
(1)二个五氧化二磷___________________;
(2)硫酸铁[Fe2(SO4)3]_____________________;
(3)胆矾[CuSO4·5H2O]_____________________。
19. ⑴284 ⑵400 ⑶250
20.根据碳酸钠晶体(Na2CO3·10H2O)的化学式计算:
(1) 晶体的相对分子质量;20.(1)286 (2)Na:C:O:H元素质量比为:23:6:104:10 (3)62.9%
(2) 晶体中各元素的质量比;
(3) 晶体中结晶水的质量分数。
21.400克质量分数为80%的Fe2O3赤铁矿石与多少克含Fe3O4质量分数为70%的磁铁矿石含铁量相等?
21.441.9克
22.有一不纯的硫酸铵样品(所含杂质不含氮),经分析知道它含有20%的氮,求样品里含(NH4)2SO4的质量分数。 22. 94.3%
二、有关化学方程式的计算
一、选择题
1.6克碳在空气中充分燃烧,可向大气中排放温室气体(CO2)的质量是( ) 1.B
A.44克 B.22克 C.11克 D.6克
2.相同质量的下列物质,完全燃烧时需要的氧气最多的是( ) 2.D
A.甲烷(CH4) B.一氧化碳 C.硫 D.氢气
3.制取4.4克二氧化碳气体,需要含杂质5%的石灰石约是( ) 3.C
A.9.5克 B.10克 C.10.5克 D.11克
4.磷在氧气中燃烧制得10克五氧化二磷,假定氧气是由氯酸钾分解制得的,那么需要氯酸钾的质量是( ) 4.B
A.15.8克 B.14.4克 C.14.0克 D.13.5克
5.把CO和CO2的混和气体8克,通入澄清的石灰水中,最多可生成白色沉淀5克,则混和气体中CO和CO2质量比为( ) 5.A
A.29︰11 B.8︰5 C.25︰11 D.8︰11
6.根据质量守恒定律,2克氢气和20克氧气可以生成水( ) 6.A
A.18克 B.22克 C.36克 D.无法确定
7.a克金属M与盐酸反应,生成b克的氢气和化合物MCl2,金属M的相对原子质量是( ) 7.B
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.钠、镁、铝分别跟足量稀硫酸反应,生成等质量的氢气时,参加反应的钠、镁、铝的原子数目之比是( ) 8.C
A.1∶2 B.3∶2 C.2∶1 D.3∶4
9.将m克CO2通入足量Ca(OH)2溶液中得沉淀A克,若将m克CO2经过如下变化:CO2+C─→CO;
CO+O2─→CO2,再将CO2通入足量Ca(OH)2溶液得沉淀B克,则A和B的关系( ) 9.B
A.A=B B.2A=B C.A=2B D.A>B
10.把两种金属的混合物6克,放入足量的稀盐酸中完全反应,结果得到氢气0.2克。则混合物的成分可能是
( ) 10.CD
A.Fe和Cu B.Mg和Fe C.Zn和Fe D.Al和Zn
二、填充题
11.实验室制取4.8克氧气,需要氯酸钾_______________克。 11. 12.25
12.工业上在高温下锻烧_______________制取生石灰和二氧化碳,其化学方程式是___________________________________。锻烧1吨含杂质10%的石灰石,可制得_____吨生石灰,及_____________吨二氧化碳。
12.石灰石; CaCO3![]() CaO+CO2↑;0.504;0.396
CaO+CO2↑;0.504;0.396
13.把6.5克锌粒和6.4克铜片同时投入硝酸银溶液中,待反应停止后铜片的质量变为3.2克,此时溶液中大量存在的阳离子是______________和__________。化学方程式是_________________、____________________,生成银的质量是_______克。
13. Zn2+;Cu2+;Zn2++2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu(NO3)2+2Ag; 32.4
三、实验题
14.下图是实验室用氢气还原氧化铜实验的示意图。
(1)试管口应略向下倾斜,原因是__________________________________________________;
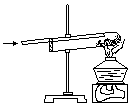 (2)实验开始时,应该向试管中先通一会儿氢气,再用酒精灯给试管加热,这是为了__________________________________________________;
(2)实验开始时,应该向试管中先通一会儿氢气,再用酒精灯给试管加热,这是为了__________________________________________________;
(3)反应完成时,应先熄灭酒精灯,等试管冷却后再停止通入氢气,这是为了____________________________________________________;
(4)实验过程中,观察到的现象是___________________________________________________;
(5)在这个反应中,氧化剂是______________________;
(6)实验室用氢气还原5.6克氧化铜,计算:至少有多少克氢气参加了反应?这些氢气在标准状况下的体积是多少升?(标准状况下氢气的密度按0.09克/升计算) 14.(1)防止生成的水倒流炸裂试管(2)使试管中为纯氢气,以防爆炸(3)生成的铜不再被氧化为氧化铜(4)黑色固体粉末变为亮红色、试管口出现无色液滴(5)氧化铜(6)0.14克;1.56升
四、计算题
15.质量分数为80%的赤铁矿8000吨,最多可炼含铁质量分数为94%的生铁多少吨?15.4766吨
16.20克铁粉和铜粉的混和物与100克稀硫酸恰好完全反应,生成氢气0.5克。计算:
(1)混和物中铁粉和铜粉各多少克?
(2)稀硫酸中溶质的质量分数是多少?
16. ⑴铁粉14克;铜粉6克 ⑵24.5%
17.取25克16%的氢氧化钠溶液,逐滴加入20%的稀硫酸,当它们相互反应完全时,消耗了这种稀硫酸多少克?其体积是多少毫升?(20%稀硫酸的密度为1.14克/厘米3)
17. 24.5; 21.5
18.现有20℃时饱和硫酸铜溶液48克,(20℃时硫酸铜的溶解度是20克),跟一定浓度的氢氧化钠溶液25克恰好完全反应生成蓝色沉淀,求:
(1)生成沉淀多少克?
(2)氢氧化钠溶液中溶质的质量分数是多少?
(3)将沉淀过滤后,剩余溶液中溶质的质量分数是多少?
18. ⑴ 7.35 ⑵ 24% ⑶ 16.2%
三、有关溶液的计算
一、选择题
1.把10克氯化钠放入40克水中,完全溶解后,溶液中氯化钠的质量分数为( ) 1.B
A.10% B.20% C.25% D.33.3%
2.t℃时,18克硝酸钾全部溶于水形成68克饱和溶液,则t℃时硝酸钾的溶解度是( ) 2.C
A.18 B.36 C.36克 D.50克
3.有50克5%的某溶液,将其溶质质量分数降低一半,可采取的方法是( ) 3.D
A.加入25克水 B.取出2.5克溶质 C.取出25克水 D.加入50克水
4.已知20℃时NaCl的溶解度为36克,20℃时在50克水里最多溶解NaCl的质量是( ) 4.A
A.18克 B.36克 C.50克 D.100克
5.将300克90%的硫酸稀释为60%的硫酸需加水( ) 5.C
A.230克 B.180克 C.150克 D.200克
6.20℃时,50克饱和硝酸钾溶液蒸干,得到12克硝酸钾晶体,此温度下硝酸钾的溶解度是( ) 6.D
A.24克 B.24% C.31.6 D.31.6克
7.在25℃时,硝酸钾溶液的质量分数为25%,则25℃时硝酸钾的溶解度是( ) 7.D
A.33克 B.25克 C.18克 D.无法确定
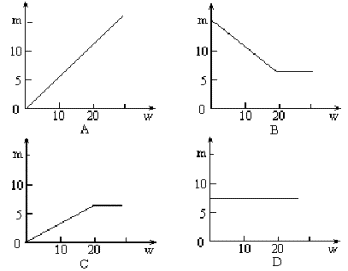
8.将7.2克NaCl加水完全溶解后,继续加水稀释。若以横坐标表示加水质量W(克),以纵坐标表示溶液中溶质质量m(克),下列关系正确的是( ) 8.C
二、填充题
9. 20℃时,把9克氯化钠溶解在25克水里,恰好制成饱和溶液,则20℃时氯化钠的溶解度为__________克,该饱和溶液中氯化钠的质量分数为___________(计算结果保留一位小数)。 9. 36 ; 26.5%
10.20℃时,140克食盐溶液蒸发掉40克水或加入14.4克食盐,溶液均可达饱和,则原溶液中溶质质量分数是______________________。 10. 18.9%
11.26.6g硝酸钠溶于114克水中所得溶液均匀分成三等份。
(1)每1份溶液中溶质的质量分数为____________________。
(2)将一份溶液加入10克水后,所得溶液中溶质的质量分数为_______________。
(3)将一份溶液再溶解10克硝酸钠,所得溶液中溶质的质量分数为______________。
(4)再将一份溶液稀释为原溶质质量分数的一半,应加水的体积为_____________毫升。
11. ⑴ 18.6% ⑵ 15.6% ⑶ 33.2% ⑷ 46.9毫升。
12.30℃时,甲杯中盛有80克食盐饱和溶液,乙杯中盛有40克食盐饱和溶液。若各自蒸发掉20克水后再冷到30℃时,甲杯中析出m1克食盐晶体,乙杯中析出m2克食盐晶体,则m1与m2的大小关系是(填大于、小于、相等)__________________。30℃时食盐的溶解度是_____________________(用含有m1或m2的式子表示)。
12.相等;5m1克(或5m2克)
13.在t1℃时硝酸钾饱和溶液中溶质的质量分数为20%,则t1℃时硝酸钾的溶解度是__________克,已知t2℃时硝酸钾的溶解度为t1℃时溶解度的三倍,t2℃时硝酸钾饱和溶液中溶质的质量分数是______________%。 13. 25;42.9%
14.80℃时50克水中能溶解NaNO375克恰好饱和,80℃时NaNO3在水中的溶解度为______________克,该溶液的溶质质量分数是___________。 14. 150;60%
三、计算题
15.某温度下,有饱和食盐溶液100毫升(密度为1.2克/厘米3),把它蒸发干后,得到食盐31.7克,求此温度下食盐的溶解度。 15. 36克
16.取粉末碳酸钠样品(含有杂质氯化钠)12克,放入50克14.6%的盐酸中恰好完全反应。求:
①样品中碳酸钠的质量分数?
②样品跟盐酸反应后溶液中溶质的质量分数是多少? 16. ①88.3% ②22.7%
17. 已知20℃时氯化钾的溶解度为34.2克。向一定量的溶质的质量分数为50%的氢氧化钾溶液中加入溶质的质量分数为36.5%的浓盐酸10克,两者恰好完全反应,如果反应后溶液的温度为20℃,试求反应后所得溶液的质量。
17. 解:设参加反应的KOH的质量为x,生成的KCl的质量为y


20℃时,13.75克水最多能溶解KCl的质量为:

【答案】
一、有关化学式的计算
一、选择题
1.A 2.D 3.C 4.B 5.C 6.C 7.D 8.B 9.C 10.B 11.D 12.B 13.D 14.AC
二、填充题
15. 162
16. 32
17. XY3
18. N2O;63.6%;N2O5;26%
三、计算题
19. ⑴284 ⑵400 ⑶250
20.(1)286 (2)Na:C:O:H元素质量比为:23:6:104:10 (3)62.9%
21.441.9克
22. 94.3%
二、有关化学方程式的计算
一、选择题
1.B 2.D 3.C 4.B 5.A 6.A 7.B 8.C 9.B 10.CD
二、填充题
11. 12.25
12. 石灰石; CaCO3![]() CaO+CO2↑;0.504;0.396
CaO+CO2↑;0.504;0.396
13. Zn2+;Cu2+;Zn2++2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu(NO3)2+2Ag ; 32.4
三、实验题
14.(1)防止生成的水倒流炸裂试管(2)使试管中为纯氢气,以防爆炸(3)生成的铜不再被氧化为氧化铜(4)黑色固体粉末变为亮红色、试管口出现无色液滴(5)氧化铜(6)0.14克;1.56升
四、计算题
15.4766吨
16. ⑴铁粉14克;铜粉6克 ⑵24.5%
17. 24.5; 21.5
18. ⑴ 7.35 ⑵ 24% ⑶ 16.2%
三、有关溶液的计算
一、选择题
1.B 2.C 3.D 4.A 5.C 6.D 7.D 8.C
二、填充题
9. 36 ; 26.5%
10. 18.9%
11. ⑴ 18.6% ⑵ 15.6% ⑶ 33.2% ⑷ 46.9毫升。
12. 相等;5m1克(或5m2克)
13. 25;42.9%
14. 150;60%
三、计算题
15. 36克
16. ①88.3% ②22.7%
17. 18.5克