初三化学(第16周)复习
主讲教师:季进明
主审教师:谢兆贵
【复习内容及要求】
1、氢气的制法、性质和用途,主要掌握H2的实验室制法及其化学性质
2、单质的碳、碳的氧化物,主要掌握它们的化学性质以及CO2的实验室制法
3、了解生石灰、石灰石及大理石的用途,常识性认识几种有机物
4、铁的性质,主要是铁的化学性质,认识生铁和钢都是以铁为主要成分的合金,几种常见金属及合金的应用。
【复习讲解】
一、氢气、二氧化碳的性质、用途的比较
|
| H2 | CO2 | |||||||||
| 物理性质 | 密度 | 比空气小得多 | 比空气大,约是空气密度的1.5倍 | ||||||||
| 溶解性 | 难溶解于水 | 能溶解于水 | |||||||||
|
| (1)常温下比较稳定 (2)可燃性 2H2+O2===2H2O (3)还原性 H2+CuO===Cu+H2O
yH2+FexOy===xFe+yH2O | (1)“三不”:不能燃烧,不能支 持一般物质燃烧不能供给呼吸 (2)酸性氧化物的性质 CO2+H2O=H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O CO2+2NaOH=Na2CO3+H2O (3)一定条件下有氧化性 CO2+C===2CO (4)参与光合作用 | |||||||||
| 用 途 | 气体燃料、高能燃料 冶金工业的还原剂,保护气 制盐酸,合成氨等 | 用于灭火(原理) 化工原料,制纯碱,汽水,尿素 干冰作致冷剂,人工降雨,舞台布景,保藏易腐败的食物。 温室肥料 | |||||||||
二、氢气和CO2的实验室制法比较
|
| H2 | CO2 | |
| 原料及条件类型 | 锌粒、稀硫酸常温反应,置换反应 | 石灰石或大理石与稀盐酸常温反应,复分解反应 | |
| 化学反应原理 | Zn+H2SO4=ZnSO4+H2↑ | CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
|
| 这两种气体制备时,原料都是用块状难溶于水的固体与液体常温制气体,所以气体的发生装置可以完全相同,如下几图均可,其中d可做到随时加酸,e甚至还可让反应随时发生或停止 课本中出现的是a与d,其中d的长颈漏斗最下端一定要浸入到液面以下 | ||
| 收集装置及方法 | 由气体的溶解性和密度共同决定 | ||
| 排水法 —难溶于水 或向下排空气法 —密度很小 | 一般只用向上排空气法—密度比空气大 (验满:燃烧木条伸到瓶口) | ||
| 操作过程 | 都是连接装置,检查气密性,然后装药品(固及液)固定后收集 | ||
| 生成物的验证 | 点燃后有淡蓝色火焰,只生成水 | 通入石灰水、石灰水变浑浊 | |
三、氢气、碳、一氧化碳的比较
|
| H2 | C | CO | |||||||||||||||||
| 状态 | 气 | 固 | 气 | |||||||||||||||||
| 类别 | 非金属单质 | 非金属单质 | 非金属氧化物 | |||||||||||||||||
|
| (1)可燃性 | 2H2+O2===2H2O | C+O2===CO2 2C+O2===2CO | 2CO+O2===2CO2 | ||||||||||||||||
| (2)还原性 | yH2+CuxOy==xCu+YH2O | C+2CuO==2Cu+CO2↑ | CO+CuO==Cu+CO2 3CO+Fe2O3==2Fe+2CO2 | |||||||||||||||||
| (3)不同之处 | H2、C常温下性质稳定;CO还有毒性 | |||||||||||||||||||
四、零碎的知识
1、H2的工业制法①电解水 ②水煤气转化及分离 ③天然气
![]() 2、单质的碳 金刚石:天然物质中最坚硬。用途:钻石、装饰品、钻探机钻头
2、单质的碳 金刚石:天然物质中最坚硬。用途:钻石、装饰品、钻探机钻头
石 墨:质软、导电性、滑腻。用途:铅笔芯、电极、润滑剂
3、生石灰、石灰石、大理石的用途
(1)生石灰CaO CaO+H2O=Ca(OH)2 CaO可作碱性干燥剂 Ca(OH)2有很多用途,见课本P167
|
CaCO3===CaO+CO2↑
石灰石 生石灰
(3)大理石的主要成分是CaCO3,坚硬、致密、美观、价贵,直接做装饰材料
|
|
|
![]() (1)与O2 纯O2 3Fe+2O2===Fe3O4
(1)与O2 纯O2 3Fe+2O2===Fe3O4
潮湿空气中缓慢氧化而生锈
![]() (2)与酸 Fe+2HCl==FeCl2+H2↑
(2)与酸 Fe+2HCl==FeCl2+H2↑
铁表面有气泡产生,溶液由无色变成浅绿色(Fe2+)
Fe+H2SO4==FeSO4+H2↑
![]() (3)与盐 Fe+CuSO4==FeSO4+Cu
(3)与盐 Fe+CuSO4==FeSO4+Cu
现象:铁的表面有红色物质覆盖,溶液由蓝色变成浅绿色
Fe+2AgNO3==2Ag+Fe(NO3)2 溶液质量减轻
56 216
6、合金:由一种金属跟其它一种或几种金属(或金属跟非金属)一起熔合而成的具有金属特性的物质。
7、生铁和钢的比较
| 生铁 | 钢 | ||||
| 主要成分 | Fe | Fe | |||
| 含碳量 | 2-4.3% | 0.03-2% | |||
|
| 白口铁、灰口铁、球墨铸铁 | 低碳钢 不锈钢 碳素钢 中碳钢 合金钢 钨钢 高碳钢 锰钢 硅钢 | |||
|
| 原料 | 铁矿石、焦炭、石灰石 | 生铁、废钢等 | ||
| 设备 | 高炉 | 转炉、电炉、平炉 | |||
| 主要原理 | 高温条件下,用CO从铁的氧化物中将铁还原出来,如3CO+Fe2O3==2Fe+3CO2 | 在高温条件下,用O2或铁的氧化物将生铁中过多的C和其它杂质转变为气体或炉渣而除去 | |||
| 力学性能 | 硬而脆,可铸不可锻 | 软硬而韧,有弹性,可铸又可锻轧 | |||
8、常见的几种其它金属
| 铝 | 铜 | 锌 | 钛 | |
| 化学式 | Al | Cu | Zn | Ti |
| 特殊性及用途 | 表面形成致密氧化膜、耐空气、水、浓HNO3的腐蚀导电性Ag>Cu>Al轻金属、铝合金 | 常温下不活泼但在潮湿的空气中会产生铜绿 电线、电器、仪表、枪弹、化工器材 | 表面有致密的氧化膜、薄膜、电镀、铜合金、干电池负极 | 轻金属、熔沸点高、良好延展性,耐空气、海水、HNO3、稀H2SO4的腐蚀,新型材料:造船航天、反应器等。 |
【一周一练】
一、选择题:
1、下列变化中属于物理变化的是( )
A、CO2通入到水中 B、干冰放在空气逐渐消失
C、实验室制取CO2 D、石墨在高温高压下转变成金刚石
2、几年前,科学家研制出一种新的分子,它的化学式为C60,下列说法:
①C60是一种新型化合物 ②C60也是一种碳单质 ③C60的相对分子质量为720 其中正确的是( )
A、①②③ B、②③ C、③ D、①②
3、下列变化,说明碳具有还原性的是( )
A、CO2和木炭粉高温反应生成一氧化碳
B、活性炭吸附毒气
C、木炭使红墨水中的红色消失
D、木炭分写一种黑色粉末混合强热后生成一种红色金属
4、①C ②O2 ③CO ④CO2 四种物质,它们之间不能发生化学反应的是( )
A、①与② B、②与④ C、③与④ D、①与④
5、下列各组物质中,常温不能反应的是( )
A、一氧化碳和氧化铜墙铁壁 B、二氧化碳和水
C、二氧化碳和石灰水 D、氢气和氧化铜
6、可用同一种方法收集的气体组是( )
A、O2、H2、CO2 B、O2、CO2、CO C、H2、O2、CO D、H2、CO、CO2
7、下列各组物质在空气中燃烧时都有火焰,且发生的反应都是化合反应的是( )
A、C和CO B、H2和CH4 C、Fe和P D、CO和H2
8、下列过程能使空气中CO2的体积分数变大的是( )
A、工业上制生石灰 B、建筑工地上用熟石灰彻砖抹墙
C、植物的光合作用 D、大量使用煤、石油、天然气
9、下列说法错误的是( )
A、碳的氧化物不一定有毒 B、碳的氧化物不一定是酸性氧化物
C、碳在氧气中燃烧不一定生成二氧化碳 D、含碳元素的化合物都是有机物
10、下列气体①O2 ②H2 ③CO2 ④CO ⑤SO2 ⑥HCl中都含有水蒸气,其中不能用碱石灰干燥的是( )
A、③⑤⑥ B、①②③ C、③④⑤ D、④⑤⑥
11、有三个容积相同的容器,在相同条件下分别充满O2、H2、CO2、CO,则它们所盛气体的质量由大到小的顺序是( )
A、O2、H2、CO2、CO B、CO2、O2、CO、H2
C、H2、O2、CO、CO2 D、H2、CO、O2、CO2
12、将H2、O2、N2的混合气体20g,点燃完全反应后生成18g水,则剩余气体不可能是为( )
A、N2 B、H2、O2、N2的混合气
C、H2、N2的混合气 D、N2、O2的混合气
13、铁生锈主要是( )
A、铁与氧气反应 B、铁与水反应
C、铁与空气中N2、H2O反应 D、铁与空气中O2、H2O发生复杂的反应
14、等质量的下列物质燃烧时,生在的CO2最多的是( )
A、C B、CO C、CH4 D、C2H2
15、两种金属粉末的混合物30g,与足量稀硫酸反应生成1g H2,则这种混合物可能是( )
A、Fe和Mg B、Fe和Zn C、Fe和Cu D、Mg和Al
16、下列化合物中碳元素化合价+4价的是( )
A、CH4 B、CO C、Mg(HCO3)2 D、CO(NH2)2
17、将16g O2与12g C放在密闭容器中强热充分反应,最终容器中有( )
A、22g CO2 B、28g CO2 C、28g CO D、22g CO2和6g C
18、在氧化铜和铁粉的混合物中,加入一定量的稀H2SO4并微热,反应停止后滤出不溶物,再向滤液中插入铁片,铁片上无变化,则滤液中( )
A、一定无CuSO4,一定含FeSO4 B、一定无CuSO4,可能有FeSO4
C、一定含CuSO4和FeSO4 D、一定含FeSO4,可能有CuSO4
19、甲、乙、丙、丁都是含碳元素的物质,它们之间有如下转化关系:
(1)甲+丙 乙 (2)乙+O2 丙 (3)丁在高温下分解可得到丙,则按甲、乙、丙、丁依次排列的顺序正确的是( )
A、C、CO、CO2、CaCO3 B、C、CO2、CO、Na2CO3
C、CO、C、CO2、CaCO3 D、CO2、C、CO、CaCO3
20、下列说法不利于改善环境的是( )
A、农民将秋后农作物秸秆焚烧 B、大力提倡使用沼气,限制使用化学肥料
C、改用氢气为原料冶炼金属
D、限制燃油小轿车的数量扩大,提倡市民乘大型公交车
二、填空题:
21、按照不同的反应类型,各写出两个生成CO2的反应的化学方程式:
(1)化合反应 、 ;
(2)分解反应 、 ;
(3)置换反应 、 ;
(4)复分解反应 、 。
22、有一包混合物,其中可能混有适量的炭粉、碳酸钙、氧化铜、氧化铁中的一种或几种,现进行下列实验:①取样,隔绝空气,加热至高温产生一种气体,该气体能使石灰水变浑浊;②把足量的稀盐酸滴入到冷却后的固体残留物中,固体全部溶解,并产生一种可燃性气体。
问:(1)原混合物中一定不含有 ;(2)原混合物中一定含有 ;在实验过程中肯定发生的反应的化学方程式为 ;(3)原混合物中可能含有的物质是 ,证明它是否存在的方法是 。
23、已知A元素原子核外共有6个电子,B元素原子核外有2个电子层,最外层电子数比次外层多4个,C元素的正一价阳离子的电子层结构与氖原子相同,则A、B、C三种元素组成的一种化合物的化学式为 ,该化合物由 和 构成,它与盐酸反应的化学方程式为 。
24、工业上制造牙膏时要向配料中添加轻质CaCO3粉末,它是以石灰石为原料进行到分料,化合等反应制成的,写出制造轻质CaCO3的有关反应方程式
(1) (2) (3) 。
25、锥形瓶中用金属a与某酸反应制取氢气,并用纯净的氢气还原Fe2O3样品通过碱石灰吸水质量增加以测定Fe2O3样品的纯度所用的试剂有NaOH溶液,稀盐酸,浓H2SO4,试回答下列问题:
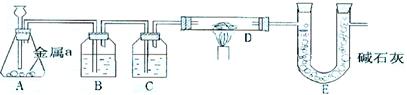 |
(1)仪器A中应注入的溶液是 ,B中的溶液是 作用是 C中的溶液是 作用是 。
(2)D中的化学反应化学方程式
(3)若A中金属a消耗2.8g,且从A中导出H2质量为0.1g,则该金属的原子量为 。
(4)若D中原固体质量为20g,E中碱石灰质量增加5.4g,则原Fe2O3样品中Fe2O3的质量分数为
(5)①若无C装置或B装置,则对Fe2O3测出的质量分数的影响是 (填偏大、偏小、不变、下同)
②若D中水蒸气未全部排出,则对测出的Fe2O3质量分数的影响是
③若D中Fe2O3未全部反应完,则对测出的Fe2O3质量分数的影响是
④若空气对E发生了影响,则对测出的Fe2O3质量分数的影响是
⑤若开始时忘记称量E的质量,但已测定过原样品的质量,对测定Fe2O3质量分数时还应测定
。
三、计算题
26、某炼铁厂冶炼生铁过程中有2%的铁损失,该厂每天生产含杂质的质量分数为4%的生铁80t,求需要含氧化铁的质量分数为70%的赤铁矿石多少吨?
【一周一练答案】
一、1、B 2、B 3、AD 4、BC 5、BC 6、C
7、D 8、AD 9、D 10、A 11、B 12、B
13、D 14、A 15、BC 16、CD 17、C 18、A 19、A 20、A
二、21、22、23略
|
|
(2)3H2+Fe2O3===2Fe+3H2O
(3)56 (4)80%
(5)①偏大 ②偏小 ③偏小 ④偏大 ⑤Fe2O3被完全还原后剩余固体的质量
三、略
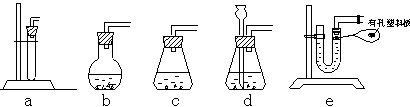 气体发生装置
气体发生装置 分类
分类