初三化学第一次月考
姓名________学号__________班级_________成绩_________
考生注意:
1、 试卷分第一部分和第二部分,第一部分满分50分,第二部分满分50分,本卷满分100分。全卷共八大题。考试时间90分钟。
2、解题可能用到的相对原子量:H—1 O—16 C—12 N—14 Cu—64 S—32
Mg—24 Cl—35.5
第一部分
一、 (10分)选择题,每小题只有一个正确答案,将正确答案的序号填入括号内
1.下列变化中,属化学变化的是………………………………………………( )
A.石蜡融化 B.铁铸成铁锅 C.铜绿受热分解 D.灯泡发光
2.下列表述化学式H2O的意义中,错误的是………………………………….( )
A.表示一个水分子 B.表示水分子中含有氢分子和氧原子
C.相对分子质量为18 D.表示水的组成
3.A克KClO3和B克MnO2混合加热,得到C克残渣,则生成O2质量为( )
A.(A-C)克 B.(A+B-C)克
C.(A-B-C)克 D.(A-B+C)克
4.下列物质属于溶液的是……………………………………………………..( )
A.汽水 B.铁水 C.牛奶 D.泥水
5.下列物质中,由分子构成的单质是………………………………………….( )
A.氧气 B.水 C.二氧化碳 D.铝
6.下列物质中,具有固定组成的是…………………………………………….( )
A.空气 B.天然气
C.氯化钠 D.氢气和氧气的混合气体
7.下列变化中,属于分解反应的是……………………………………………..( )
A. 一氧化碳+氧气![]() 二氧化碳
B。铜+氧气
二氧化碳
B。铜+氧气![]() 氧化铜
氧化铜
C.碱式碳酸铜![]() 氧化铜+水+二氧化碳
氧化铜+水+二氧化碳
D.食盐水![]() 食盐+水
食盐+水
8.对CO2、NO2、SO2所代表的三种物质的下列叙述中,正确的是…………( )
A. 都含有氧分子
B. 组成三种物质的元素种类完全相同
C. 各物质中氧元素的质量分数相同
D.在各一个分子里所含氧原子的个数相同
9.将100mL水(密度为1g/cm3)与100mL酒精(密度为0.8g/cm3)混合均匀,所得溶液中溶质的质量分数为…………………………………………………………..( )
A.40% B.50% C.44.4% D.无法判断
10.氮元素的氧化物中,若氮元素和氧元素的质量比7:20,则该氧化物的化学式为( )
A.NO B.NO2 C.N2O D.N2O3
二、 填空题(本题28.5分)
11、(6分)填表(物质类别填写单质、氧化物)
| 物质名称 | 氩 气 | 氧化铝 | 水 银 | |||
| 化学式 | P2O5 | Fe3O4 | H2O | |||
| 物质类别 |
12、(5分)用化学符号表示:
⑴2个氢原子 ;⑵3个二氧化碳分子 ;⑶m个铁原子 ;⑷10个五氧化二磷分子 ;⑸4个氮分子 。
13、(4分)用化学式填写:
⑴空气中含量最多的气体 ;⑵分子量最小的氧化物 ; ⑶地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物 ;⑷核内无中子的原子是 。
14、(2分)实验室通常将少量的白磷保存在 中,金属钠保存在 中。
15、(6分)完成下列反应的化学方程式,并在括号内注明反应的类型(化合或分解)
⑴镁在空气中燃烧 ( 反应)
⑵铜绿受热变黑 ( 反应)
⑶白磷自燃 ( 反应)
⑷硫黄燃烧 ( 反应)
16、(2分)在通电分解水的实验中,相同条件下产生氢气与氧气的体积比为 ;
它们的质量比为 。
17、(2分)已知硝化甘油的化学式为C3H5(ONO2)3,该物质一个分子中共有 个原子,其中碳、氢元素质量比为 。
18、(1.5分)天然水体的主要污染物:_________、___________和_________________。
三、实验题(每空0.5分)
19、㈠、实验室以氯酸钾为原料制取,并用排水法收集氧气。
(1)在下列仪器中,除试管外,还必须用到哪些仪器?(填仪器名称)
________________、_______________、________________、________________。
(2)实验前用带有导管的橡皮塞塞紧试管后,要检查装置的__________。装配仪器时,要使试管口略__________倾斜,并使铁夹夹在试管的__________部。
(3)加热时,要先使试管__________受热,然后再集中加热放药品的部位。
(4)停止加热时,要先把__________移出水面,然后再熄灭火焰。
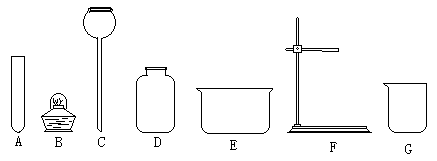
⑵、改正下列各图中出现的错误。
实验室收集氧气
 |
|
四、(6分)计算题
20、根据尿素的化学式CO(NH2)2,计算:⑴相对分子质量⑵各元素质量比
⑶氮元素的质量分数⑷120克尿素中含氮元素多少克?
第二部分
五、选择题(本题共12分)每小题只有一个正确答案
21、下列叙述正确的是…………………………………………………………( )
A.纯净物一定是由分子构成的 B.由同种分子构成的物质一定是纯净物
C.混合物肯定是由两种以上元素组成的 D.物质与氧气的反应叫氧化反应
22、按质量计算,无论在地壳里,还是在空气中或生物细胞内,其含量都很丰富的一种元素是………………………………………………………………………………( )
A.O B.H C.Al D.C
23、某化合物(用X表示)燃烧时发生的反应为X+3O2=2CO2+3H2O,根据质量守衡定律,可判断出X的化学式是…………………………………………………………( )
A.C2H6 B.C2H5OH C.C2H2 D.C2H4O
24、现有化学反应A+C=D,已知A、B、C三种物质各12克(其中B为催化剂),加热进行反应,当A已完全反应后,测得生成D16克,则反应后混合物中B和C的质量比是………………………………………………………………………………( )
A.4∶1 B.5∶1 C.3∶1 D.3∶2
25、下列物质中,氮元素的质量分数最大的是………………………………( )
A.NH4HCO3 B.NH4Cl C.CO(NH2)2 D.NH4NO3
26、配制一定质量分数的食盐水,无需用到的仪器是………………………( )
A.酒精灯 B.烧杯 C.量筒 D.玻璃棒
六、填空题(本题共24分)
27、(3分)在2H2O2=2H2O+O2反应中,反应前后发生改变的微粒是 ,生成的新的微粒是 ,在此反应中 微粒没有改变。
28、(2分)已知A、B两元素相对原子质量比为7∶2,由A、B形成化合物中两元素质量比为21∶8,则该化合物化学式为 。
29、(2分)质量相等的SO2和CO2中,氧元素的质量比为 ,氧原子的个数比为 。
30、(2分)已知化学反应A+2B=C+D中,测得20克A跟10克B完全作用生成12.25克C和 克D,已知D的相对分子质量为35,则B的相对分子质量为
31、(4分)实验室现想用MnO2作KClO3分解的催化剂,却找不到MnO2药品,可用 代替,此时生成O2比直接用MnO2作催化剂 (填多、少或相等),请依次写出两个化学方程式 、
32、(4分)在100克水中加入2克NaCl和3克KCl,完全溶解后,溶液的质量是 ;现有一杯接近饱和的氢氧化钙溶液欲变成饱和溶液,可采用 、 、
三种方法。
33、(6分)现①液氮 ②铜绿 ③铜粉 ④干冰 ⑤冰水混合物 ⑥氯酸钾溶液 ⑦空气 ⑧澄清石灰水八种物质填空:
(1)含有氧元素的是 ,(2)含有氧分子的是 ,
(3)属于含氧化合物的是 ,(4)属于氧化物的是 ,
(5)属于单质的是 ,(6)属于混合物的是 。
七、实验题(本题共5分)
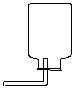
34、右图实验室用高锰酸钾制氧气的装置图,现有五处错误,请指出并加以改正
(1)
(2)
(3)
(4)
(5)
八、计算题(本题共9分)
35、现有含H2SO4的质量分数为98%、密度为1.84g/mL的浓硫酸,要配制490mL密度为1.2g/mL溶质质量分数为20%的硫酸溶液,需用浓硫酸和水各多少毫升?
36、取KClO3和MnO2共16克,加热一段时间后,测得有1/3质量的KClO3分解,将剩余固体冷却称量为14.08克,求原混合物中KClO3和MnO2各多少克?