 九年级模拟考试化学科试卷
九年级模拟考试化学科试卷
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 合计 |
| 得分 |
|
|
|
|
|
|
|
|
相对原子质量:N—14 Na—23 Ca—40 C—12 O—16 Ag—108 H—1 S—32
一、我会选择(每小题只有一个正确答案,把序号填入下表。每小题2分,共28分)
1.下列诗句包含化学变化的是
A.粉身碎骨浑不怕,要留清白在人间。(《石灰吟》)
B.欲渡黄河冰塞川,将登太行雪满山。(《行路难》)
C.气蒸云梦泽,波撼岳阳城。(《望洞庭湖赠张丞相》)
D.忽如一夜春风来,千树万树梨花开。(《白雪歌送武判官归京》)
2、人体内含量最多,但不属于有机物的是 ( )
A.脂肪 B.水 C. 蛋白质 D.维生素
3、物质在“潮湿的空气中”发生的变化,主要与空气中某些气体有关。下列有关说法中
不正确的是 ( )
A.钢铁生锈与氧气、水蒸气有关
B. 氢氧化钠固体潮解、变质与水蒸气、二氧化碳有关
C. 生石灰堆放久了变质与氧气、水蒸气有关
D.浓硫酸露置于空气中,溶质质量分数减小,与水蒸气有关
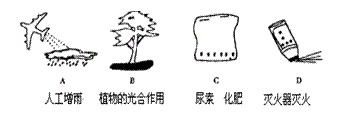
4、下列图示是二氧化碳的几种用途,其中既利用了它的物理性质,又利用了它的化学性
质的是 ( )
5、下列实验操作正确的是: ( )
A.测试溶液的pH 时,将pH试纸直接伸入待测溶液中
B.洗净后的试管,放置晾干的正确方法是管口向下,倒扣在试管架上
C.用100mL量筒取8.5mL的水
D.实验室制取气体时,可用排水集气法收集氧气和二氧化碳
6、为了探究水电解的微观过程,玉玲同学做了一些分子、原子的模型,其中能保持氢气化学
性质的粒子模型是 ( )
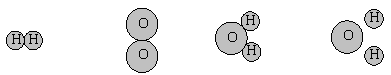 |
A. B. C. D .
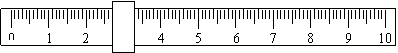
7、托盘天平调零后,在左盘衬纸上置氧化铜粉末,右盘衬纸上置1个5g砝码,游码标尺示
数如下,此时天平平衡。则被称量的氧化铜质量为 ( )
A. 8.3g B. 7.7g C. 3.3g D. 2.7g
 |
8、在进行“空气中的氧气会减少耗尽吗?”辩论中,该小组为正方(空气中的氧气会减少耗
尽)。下列论点不应成为本方论据的是:( )
A.汽车越来越多,消耗的氧气越来越多
B.有证据表明,在远古时代的原始空气中氧气含量高达30%
C.限制二氧化碳的排放是目前各国政府的重要环境政策
D.地球人口的增多,其呼吸和所用的燃料越来越多
9、用“王水”(浓盐酸与浓硝酸的混合物)溶解黄金后得到一种物质:HAuCl4(四氯合金酸),
其中金元素的化合价为:( )
A.+1 B.+2 C.+3 D.+4
10、2001年8月,科学家用单分子碳纳米管制成了世界上最小的逻辑电路。纳米碳管是一种由
碳原子构成的直径约为几纳米(1纳米=10-9米)的空心管,下列说法错误的是:( )
A.碳纳米管材料在一定条件下易将CO2还原成CO
B.碳纳米管材料表面积大能使有色溶液褪色
C.碳纳米管材料是一种特殊的有机化合物
D.碳纳米管和金刚石、石墨在一定条件下在氧气中完全燃烧产物相同
11.西班牙瑞奥汀河是一条酸河,经调查发现是由于上游河床含有的物质R在水中氧的作用下
发生反应所致,其反应的化学方程式是:2R+2H2O+7O2=2H2SO4+2FeSO4则R的化学式是:
( ) A.FeS B.Fe2S3 C.FeO D.FeS2
12.1999年报道:爆炸性的高能N5+阳离子(中子数为7)被美国加州爱德华空军基地空军研究
室研究的高能材料的化学家Karl O. Christe与他的同事W.W Wilson合成。关于N5+的说
法正确的是:( )
A.该微粒中的质子数为34
B.该微粒的电子数是34
C.该微粒由5个氮分子构成
D.它是一种由5个氮原子构成的单质分子
13.下列实验操作正确的是( )

A B C D
14.为了验证Fe、Cu、Ag三种金属的活动性顺序,现有所需金属,如果只选一种盐且实验最
简单的是:( )
A.AgNO3 B.CuSO4 C.FeSO4 D.ZnCl2
二、填空题(共24分)
15.(2分)下列两个成语与我们所学的化学知识有关。请你任选一个,简述其中的化学原理。
A、百炼成钢(将反复烧红的生铁在空气中不断锤打,转化为钢。)
B、釜底抽薪(釜:指古代炊具,相当于现在的锅;薪:指柴火。)
你选择的成语是 。其中的化学原理: 。
16.(2分)某网站报道:苏丹红一号(分子式为C16H12N20)是一系列以苏丹命名的染料之
一,食品中添加苏丹红的主要目的是为了增加红色,以长期保持辣椒制品鲜红的颜色。
我国政府早在1996年就明令禁止使用苏丹红作为食品添加剂。“苏丹红一号”由______种
元素组成,各元素的原子个数比为__________________。
17、(3分)A、B、C、D四种物质的转化关系:如下图。

A是一种氧化物,B的水溶液呈棕黄色,C是红褐色沉淀,则D是________(填化学式),
由D转化成C的化学方程式为_________________________________________。
18、(9分)在地球上分布很广,占空气体积约1/5的物质的化学式是 。煤是
现在生产、生活中的主要燃料,它燃烧时产生 气体,是造成酸雨的元凶;
因此农村常用沼气来替代化石燃料和柴禾,(1)沼气的主要成分是 。
(2)学习化学以后,自己提高了健康、安全意识。如我知道通过呼吸系统使人体中毒的物质
有 ;室内不慎起火造成火灾时,安全自救的措施有
(3)我们曾做过①木炭、②硫粉、③铁丝、④镁条等物质在足量的氧气中完全燃烧的实验。
其中燃烧时火星四射的是(用序号填写,下同) ;产生耀眼强光的是 ;
生成有刺激性气味气体的是 。上述现象有助于我们判断是否发生了化学变化、判
断化学变化发生的根本依据是 。
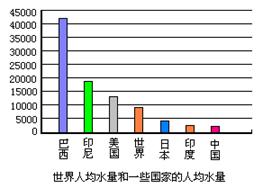 19、(3分).如图是某些国家的人均水量
19、(3分).如图是某些国家的人均水量
和世界人均水量(m3/ 人) 。
(1) 由图中可以看出我国是一个水资源
____ ___的国家。
(2) 谈谈你在生活中节约用水的二点做法
__ __ _____、__ _ ______。
20、(4分)物质之间既有相互联系,又存
在规律,这是我们学好化学应该掌握
的一种基本方法。请你仿照下表中的
示例,找出O2 、CH4 、CO2 、NH3 、
C2H4(乙烯)五种气体之间存在的另外两个规律,并排列出顺序,将答案填写在下表中
的空格内。
| 规律 | 排列顺序 |
| 示例:标准状况下,密度由小到大 | CH4、NH3、C2H4、O2、CO2 |
三、简答题(本题共23分)
21、(5分).1元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是依据元
素周期表画出的1—18号元素的原子结构示意图。我对它进行研究:
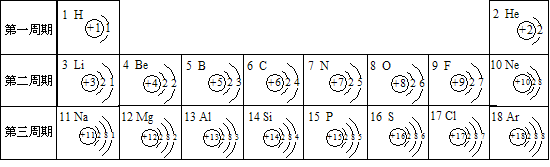
(1)原子序数为12的元素名称是 ,在化学反应中,该元素的原子容易 (填“得”或“失”)
电子;原子序数为16的元素属于 元素(填“金属”或“非金属”)。
(2)我发现如下规律:①原子序数与元素原子核电荷数在数值上相等;
② ;
③ ;
22、(6分)我市特产——庐江小红头,由于口感好,营养丰富,很受人们的欢迎。但由于容
易变质,不耐储存,所以无法在外地市场上销售,因而不能形成经济优势。如果采用真
空包装就可解决容易变质这一问题。真空包装的目的是除去空气,使大多数微生物因缺
少 气而受到抑制,停止繁殖,同时防止食品发生缓慢 而变质。当然也可采
用真空充气包装,即将小红头装入包装袋,抽出包装袋内空气,再充人防止食品变质的
气体,然后封口。真空充气包装能使食品保持原有的色、香、味及营养价值,防止食品
受压而破碎变形。充入的气体可能是:① ;② ;。你认
为食品充气包装,对所充气体的要求是:① ;② ;
23、(1分)金属铜和浓硝酸、稀硝酸反应的方程式如下:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO2↑+4H2O
工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用等体积水稀释。
试简答:用稀硝酸而不用浓硝酸的原因: ;
24.(4分)闪电雷鸣的雨天,空气中有如下化学反应发生:
①N2+02=2NO
②2NO+02=2NO
③3N02+H20=2X+NO
请回答(1)反应①②均属于___________反应(填反应类型);
(2)反应③中X的化学式是_________,推断的理由是___________。
(3)由N2→NO→N02的变化中氮元素的化合价逐步_______(填“升高”或“降低’’)。
25、(7分)在下列物质转化关系中,A,B,C,D,E,F,G,H以及蓝色沉淀都是初中化学课
本中学过的物质。在通常情况下,A、B、G是黑色固体。A、C、D、H是单质,F是硫酸盐,C在氧气中燃烧可生成B,反应①②③④都属于置换反应。A与B反应除生成C外,还生成一种能使澄清石灰水变浑浊的气体。
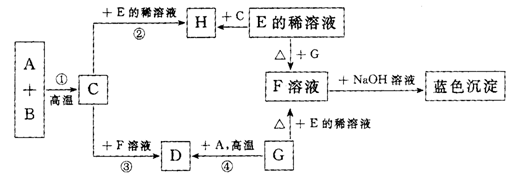
(1)写出下列物质的化学式:C ,G 。
(2)写出上述转化关系中下列反应的化学方程式,并指出E和G反应的反应类型(置换、化
合、分解、复分解)
A+B 。
E+G: ,属 反应。
四、实验题(共计13分,每空1分)
26.实验是学习化学的基础,请你根据下列实验装置解决相关问题:
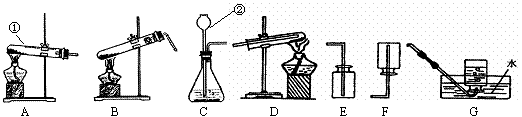
(1)写出图中编号为、①和②的仪器名称:①_______ __、②_____ ______。
(2)实验室制取氧气的化学反应方程式是_________________ __________,
利用该原理制取并收集氧气应选择图中的_______________(填仪器编号)并连接。
(3)若用氢气还原氧化铜应该选择_________(填仪器编号),氢气还原氧化铜的化学
方程式为:____________ _______________,
反应的现象是:________ _____ ___________________。
27.小明想用实验的方法鉴别家中的食盐和纯碱,他设计了以下的实验步骤,请你和他一起
完成实验报告。
实验目的:___________________________________________________。
仪器和试剂:试管、药匙、胶头滴管、带导管的橡皮塞、食醋、澄清的石灰水。
实验过程:
| 实验步骤 | 现 象 | 结论(或化学方程式) |
| (1)在A、B两支试管中各取少量样品,分别滴加食醋 | A试管中无明显现象 B试管中产生气泡 | 装入A试管的物质是_______ 装入B试管的物质是_______ |
| (2)用带导管的橡皮塞塞紧试管B,将B试管中生成的无色无味的气体通入______________ | 变浑浊 | 说明产生的气体是二氧化碳,证明纯碱中含有碳酸根 |
28、(2分)溶液pH值越小,酸性越 (填“强”或“弱”)。当溶液pH=10时,加
入紫色石蕊试液后,溶液呈 色。
五.计算题(本题包括2小题,共12分。)
29、制取22吨二氧化碳,需煅烧含杂质20%的石灰石多少吨?可得到的固体剩余物中氧化钙的
质量分数是多少?
30(7分)某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH
溶液来清洗这些硫酸。请计算:
(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)改石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理100kg这种产品,可
以节约多少经费?NaOH和Ca(OH)2的市场价格如下表:
| 名 称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.00 | 24.00 |