九年级第一学期期末考试化学试卷
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
说明:1.全卷共6页。考试时间80分钟,满分为100分。
2.请将选择题的答案编号填进括号内,其他试题解答写在试卷相应的位置上。
3.可能用到的相对原子质量:H-1 C-12 O-16 Cu-64 Mg-24 Cl-35.5 Ca-40
第I卷(选择题,共30分)
| 得分 |
| ||
1.下列现象中一定发生化学变化的是 ( )
A.食物腐烂 B.湿衣服晾干 C.矿石粉碎 D.海水晒盐
2.下列物质中,可看作纯净物的是 ( )
A.天然水 B.水银 C.生理盐水 D.汽水
3.资源广、燃烧值噶、无污染的新型能源是 ( )
A.煤 B.石油 C.天然气 D.氢气
4.目前我国对城市空气质量监测项目中,一般不考虑的是 ( )
A.硫氧化物 B.氮氧化物 C.二氧化碳 D.可吸入颗粒物
5.铝元素(Al)在化合物中呈+3价,则下列化学式中正确的是 ( )
A.NaAlO2 B.Al3O2 C.Al(OH)2 D.AlSO4
6.下列符号中,既表示一个原子,又表示一种元素,还表示一种物质的是 ( )
A.C72 B.N C.Pt D.H2
7.学习化学要善于用化学知识去分析、解决生产生活中的问题。从化学的角度看,下列说法中错误的是 ( )
A.进入小煤窑严禁吸烟 B.夜晚发现液化气泄露立即开灯检查
C.面粉厂、加油站严禁烟火 D.抄菜时油锅着火,可盖锅盖灭火
8.下列制取和收集气体的方法正确的是 ( )
A.用大理石和稀硫酸反应制CO2 B.用向上排空气法收集氢气
C.用KCLO3和MnO2共热制取O2 D.用向下排空气法收集氢气
9.为形象展示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子。其中表示水分解过程中不能再分的粒子是 ( )

![]()


![]()
![]()
![]()
![]() A.
B.
C.
D.
A.
B.
C.
D.
10.下列生活中的经验做法,不科学的是 ( )
A.用木炭除去冰箱内的异味 B.用无水酒精对皮肤进行消毒
C.大量的生活污水经过处理后才排放 D.石墨可用于铅笔芯
11.下面是有关实验现象的部分描述,其中正确的是 ( )
A.将带有铜绿的铜丝在酒精灯火焰上灼烧,铜丝表面变黑
B.镁条在氧气中点燃,发出耀眼的黄光,同时生成氧化镁
C.点燃一氧化碳气体,看到蓝紫色火焰,同时放出大量的热
D.带火星的木条伸进充满1:4(氧气与氮气的体积比)气体的集气瓶中木条复燃
12.现有三种常见治疗胃病药品的标签:
|
|
|
① ② ③
药品中所含的物质均能中和胃里的过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是[MgO+2HCl=MgCl2+H2O;Mg(OH)2+2HCl=MgCl2+H2O] ( )
A.①=②=③ B.①>②>③ C.③>②>② D.②>③>①
13.生活在密闭狭小的特殊环境(如潜艇、太空舱)里,O2会越来越少,CO2会越来越多,因此将CO2转化为O2,不仅有科学意义也有重要的实用价值。据科学文献报道,NiFe2O4在一定条件下既能促进CO2分解又可重复使用。NiFe2O4在此反应中是 ( )
A.粘合剂 B.制冷剂 C.防腐剂 D.催化剂
14.下列五种物质中含有碘元素,它们按下列顺序排列:①NaI ②I2 ③HIO ④X ⑤KIO4
根据这种排列规律,X不可能是 ( )
A.I(IO3)3 B.AgI C.I2O4 D.I2O5
15.在化学反应A+2B=3C+D中,6gA与8gB恰好完全反应,生成9gD。若反应生成15gC,则参加反应的B的质量为 ( )
A.8g B.12g C.16g D.24g
第II卷(非选择题,共7分)
| 得分 |
| ||
16. (4分)物质的机构决定物质的性质。已知氢元素原子的核电荷数为1。试分析:
(1)H+是结构最简单的一种阳离子,H+中含有的质子数为 ,电子数为 。
(2)NaH是一种离子化合物,其中Na元素的化合价为+1,则改化合物中氢元素的化合价为 。已知反应物中具有还原性的物质,发生氧化反应后,有元素化合价提高。请判断NaH+H2O=NaOH+H2↑反应中,反应物 (填化学式)具有还原性。
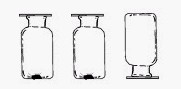 17. (3分)右图是小李同学放置在实验桌上的三瓶无色气体,它们分别是H2、O2、CO2中的某一种。(以下分别填化学式)。
17. (3分)右图是小李同学放置在实验桌上的三瓶无色气体,它们分别是H2、O2、CO2中的某一种。(以下分别填化学式)。
(1)根据瓶③倒置,可判断瓶③存放的是 。
(2)用带火星的木条放入①中,若复燃,则存放的
是 。
|
的是 。
18. (3分)CO2和O2是自然界中生命活动不可缺少的两种气体,可知它们的相同点是
;大气中若排放CO2过多会引起 效应。潮湿的空气因含
有O2使铁器 。可见任何物质都有其有利的一面,同时也有其不利的一
面。
19. (4分)小亮同学从珠江河畔取100mL浑浊的河水装在小烧杯中, 然后加入几粒明矾搅拌,静置后,观察到的现象是 。
若再采用过滤的方法净化上述小烧杯中的河水,需要的仪器有
。
20. (6分)让我们和小松一起走进化学实验室,共同来学习科学探究的方法。
小松在实验室用一小块生铁与稀盐酸反应,观察到生铁表面出现 ,
同时发现反应后的液体中有少量黑色不溶物。
提出问题:这种黑色不溶物是什么呢?
猜想与假设:这种黑色不溶物中可能含碳。
进行实验:小松按设计进行实验,得到了预想的结果。
解释与结论:由此小松得出结论:
(1)生铁中 碳(填“含”或“不含”);
(2)碳与稀盐酸 反应(填“能”或“不能”),铁与稀盐酸
反应(填“能”或“不能”)。
| 得分 |
| ||
21. (4分)空气中的CO2约占空气总体积的0.03%,但我们周围可能引起CO2含量变化的因素很多。某校初三化学兴趣小组的同学查阅有关资料后,利用稀氨水与二氧化碳中和反应的原理,设计了一个“测定学校不同地点空气中CO2相对含量”的实验方案,请你参与他们的实验过程。
(1) 将2滴浓氨水滴入500mL蒸馏水中制成稀氨水(呈弱碱性),滴入几滴 指示剂,溶液呈浅红色。将得到的溶液保存在密闭的细口瓶里。
(2) 兴趣小组的三位同学用50mL注射器吸取上述稀氨水10mL并密封,然后分别到操场、教师和宿舍三个地点抽气到50mL处,用食指堵住注射器的吸入口,充分震荡;再将注射器吸入口向上,小心将余气排出。重复上述操作若干次(n),直至注射器内的溶液 ,说明上述实验过程发生了中和反应。
(3) 完成实验数据处理,并得到结论:
| 取样地点 | 取样时间 | 抽气次数(n) | 空气中CO2的体积含量 | 结论 |
| 操场 | 2005.11.2/17:30 | 54 | 0.030% | |
| 教室 | 2005.11.2/17:30 | 36 | ||
| 宿舍 | 2005.11.2/17:30 | 45 | 03036% |
根据上述结论,要保持良好的学习和生活环境,应该注意经常打开门窗,保持通风。
22. (7分)A是一种化合物,B、D、E是三种常见气体,其中D(化合物)、E(单质)具有还原性,F为红色固体单质,C为生命中不可缺少的物质。物质A~F有如下图所示的转化关系:
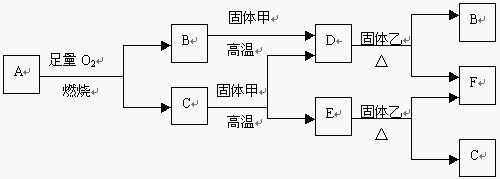
(1) 若A是由两种元素组成的气体,两种元素的质量比为3:1,则A的化学式为
;若A由三种元素组成,可作内燃机燃料。则A的化学式为 。
(2) 根据上述转化关系,按要求写化学方程式:
①化合反应: ②E转化F:
③D转化F: 。
(3) 实验室中,检验物质B的试剂是 ;工业上,D和固体乙反应的用途是 。
23. (5分)炎热的夏季,你一定想喝一杯冰水解暑。某冷饮店出售一种特制的冰水,由服务员在水中加入一些雪状的物质,改物质一放入水中立即冒出大量气泡,很快就得到一杯清凉可口的冰水,饮用时有碳酸饮料的口感。
(1)请你判断雪状的物质是 ;
(2)请你设计两个实验分别验证这种物质的成分,并填写下表:
| 操作步骤 | 实验现象 | |
| 方法一 | ||
| 方法二 |
| 得分 |
| ||
24. (8分)根据下装置图回答问题。
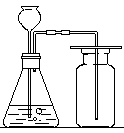
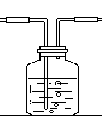
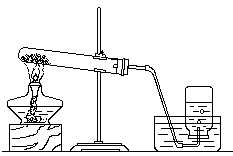
A B
(1)写出图中仪器①、②的名称① ,② ;
(2)实验室制取氧气选用的装置为 (填写装置代号,下同),反应方方程式为 ;
(3)B装置用来制取CO2,你认为是否合理 (填“是”或“否”),改正的方法是 。(若前空填“是”,改空填“无需改正”)
25. (8分)取一片洗净晾干的鸡蛋壳(主要成分为碳酸钙,不考虑其他杂质),放在酒精喷灯火焰上灼烧一段时间后,放置冷却。某同学设计了下列实验方案探究灼烧后残留固体的组成,请将有关内容记录在下表中。
| 残留固体的成分 | 探究的步骤 | 可能观察到的现象 | 结论及化学反应方程式 |
| (1)可能有氧化钙 | 取残留固体加水溶解,过滤,向滤液中滴加几滴无色酚酞溶液。 | ||
| (2)还可能有碳酸钙。 | 另取残留固体滴加足量盐酸。 |
26. (6分)酒精灯灯焰分焰心、内焰和外焰三个部分。为探究灯焰温度,科研人员用特殊的测温装置进行实验(如右下图),结果如下(探头位置是指测温探头离灯芯的垂直高度)。
 |
| 火焰 | 焰心 | 内焰 |
| ||||||
| 探头位置(cm) | 0.5 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| ||
| 火焰温度(℃) | 537 | 670 | 775 | 806 | 801 | 750 | 667 | ||
| 平均温度(℃) | 603 | 797 | 708 | ||||||
(1)观察上表数据,灯焰三部分温度由低到高的顺序为 。
(2)观察上表数据,加热实验时,被加热的仪器或物品应该放置在 位置较适宜。
(3)灯焰焰心温度较低,其原因是 。
(3) 实验中,若燃着的酒精灯中酒精不足,现要添加酒精,采取的操作是:
先 ,再向酒精灯中添加酒精。
| 得分 |
| ||
27.(6分)乳酸在医药、食品等工业中有着广阔的应用,其化学式为C3HYO3。
(1)乳酸由 种元素组成。
(2)乳酸中碳、氢元素的质量比为6:1,则Y= 。
(3)乳酸中氧元素的质量分数和乳酸中氢元素的质量分数比为 。
28.(6分)小燕同学在探究氢气还原氧化铜的实验中得到红色的固体混合物氧化亚铜(红色固体,化学式为Cu2O)和铜,经一系列的实验后测出混合物中Cu2O的质量分数为A%。请回答以下问题:(Cu2O的相对原子质量为144)
(1)小燕测出混合物中Cu单质的质量分数为 。
(2)依据题目中提供的数据,要确定改混合物中铜元素和氧元素的质量比是否需要提供混合物的总质量 (改空填“是”或“否”)
(3)设改红色固体混合物的总质量为100g,求改混合物中铜元素和氧元素的质量比。
(4)通过第(3)步的计算,我发现要确定该混合物中铜元素和氧元素的质量比,确实与提供混合物的总质量 (该空填“有关”或“无关”)。我对计算题的反思是
。