九年级化学科第九单元测试试卷
班级:______________ 姓名:___________________ 计分:____________
可能用到的相对原子质量:O:16 K:39 H:1 Fe:56 Zn:65 Na:23 S:32
Ca:40 Mg:24 Cu:64 Cl:35.5 C:12 Al:27
一、我会选(每小题只有一个正确答案。每小题2分,共44分)
1.溶液一定是 ( )
A.单质 B.化合物 C.纯净物 D.混合物
2.经测定,一杯配制好的氯化钠溶液上部溶液密度为a g/cm3,下部溶液的密度为b g/cm3,则a与b的关系是 ( )
A a<b B a>b C a=b D 无法确定
3.对于大多数固体溶质的不饱和溶液,要使之成为饱和溶液,可采用的方法有 ( )
①降低温度;②升高温度;③加同种溶质;④加溶剂;⑤恒温蒸发溶剂
A.①③⑤ B.②③④ C.①②③ D.②③⑤
4.一杯10 ℃的硝酸钾溶液,能证明它是饱和溶液的方法是 ( )
A.蒸发5 g水有固体溶质析出 B.加入少许硝酸钾晶体不溶
C.把溶液降温至 0 ℃有固体溶质析出 D.降温至0℃,加入5克硝酸钾不溶解
5.下列有关说法正确的是 ( )
A溶液都是无色的 B金属材料是指金属和金属合金
C使得一接近饱和的氢氧化钙溶液变为饱和可采取降低温度的方法
D生铁和钢都含有铁,但钢指的是纯铁
6.下列有关铁生锈的叙述错误的是 ( )
A.铁生锈时一定伴随物理变化 B.铁生锈时,铁发生了缓慢氧化
C.铁生锈的实质是铁与空气中氧气反应,生成氧化铁 D.铁生锈时会有难以察觉的热量放出
7.下列有关金属说法正确的是 ( )
A.铝在空气中能生成一层致密的氧化物保护膜
B.铜的化学性质不活泼,在潮湿的空气中也不生锈
C.保护金属资源的惟一途径是防止金属的腐蚀
D.镀锌的“白铁皮”不易生锈,说明锌没有铁活泼
8.用一氧化碳在高温下跟铁矿石反应冶铁,在这个反应里,CO作 ( )
A.氧化剂 B.还原剂 C.催化剂 D.既是氧化剂又是还原剂
9.血红蛋白的相对分子质量为68000,血红蛋白中铁的质量分数为O.33%,则平均每个血红蛋白分子中铁原子的个数是 ( )
A.1 B.2 C.3 D.4
10.在下列各种情况下,埋在地下的输油铸铁管道被腐蚀速度最慢的是 ( )
A.在潮湿、疏松的土壤中 B.在含铁元素较多的酸性土壤中
C.在干燥、致密、不透气的土壤中 D.在含砂粒较多,潮湿透气的土壤中
11.下列关于溶液的说法正确的是 ( )
A.溶液都是均一、无色的 B.溶液一定是混合物
C.稀溶液一定是不饱和溶液 D.均一、稳定的液体一定是溶液
12.现有溶质质量分数为20%的NaOH溶液50g,欲使其质量分数变为40%,可以采取 ( )
A.蒸发掉溶剂的一半 B.加入溶质20 g C. 蒸发溶剂25g D.加水25 g
13.日晒海水可以得到食盐固体,其原因是 ( )
A.受热时食盐的溶解度降低 B.受热时食盐的溶解度显著增大
C.受热时海水中的水分蒸发 D.受热时海水发生分解
14.用铁桶盛放硫酸铜溶液时间久了,铁桶漏了,原因用化学方程式表示正确的是 ( )
|
C 3Fe+2O2===Fe3O4 D 2Fe+3CuSO4=Fe2(SO4)3+3Cu
15.把一根洁净的铁钉放入稀硫酸中,下列叙述:①铁钉表面产生气泡 ②溶液由无色变为浅绿色 ③铁钉的质量减轻 ④溶液的质量变重 其中正确的是 ( )
A ①②③④ B ①②④ C ②③④ D ①②③
16.下列物质混合可以制成溶液的是 ( )
A.汽油和水 B.碳酸钙和水 C.二氧化碳和水 D.食用油和加了洗涤剂的水
17.可以作为溶液中溶质的是 ( )
A.只有气体 B.只有固体 C.只有液体 D.三种状态的物质都可以
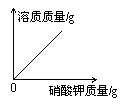
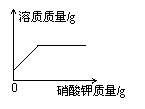 18.下列图象可以表示在一接近的饱和硝酸钾溶液中不断加入硝酸钾固体后,溶液中溶质的质量变化情况的是
( )
18.下列图象可以表示在一接近的饱和硝酸钾溶液中不断加入硝酸钾固体后,溶液中溶质的质量变化情况的是
( )
 | |||
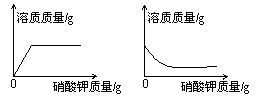 | |||
A B C D
19.下列物质不能用过滤的方法分离的是 ( )
A.泥沙和食盐 B.铁粉和糖水 C.NaCl和KNO3 D.碳酸钙和食盐
20.X、Y、Z三种金属及其化合物溶液之间可发生如下化学反应 ( )
X+ZCl2=Z+XCl2 Y+ZCl2=Z+YCl2 Y+2HCl=YCl2+H2↑ X+HCl→不反应
A.Z>X>Y B.X>Y>Z C.Y>X>Z D.Y>Z>X
21.将60时氯化铵饱和溶液冷却至室温下,下列各量保持不变的是 ( )A溶液中溶质的质量 B溶液中溶剂的质量
C溶液的质量 D氯化铵的溶解度
22.为了提高二氧化碳在水中溶解度,下列措施起到一定作用的是 ( )A增大压强或升高温度 B降低温度或减小压强
C增加水的剂量或降低温度 D降低温度或增大压强
二、我会填(每空1分,第27题2分一空,共23分)
23.在下列金属K、Cu、Mg、Zn、Al、Ca、Ag、Fe、Hg、Sn中,按金属活动性强弱顺序排列 ,其中 不能与稀盐酸发生置换反应,Cu可以把 从它的化合物溶液中置换出来。
24.用化学符号或化学式填空:
(1)硫酸铜溶液的溶质_______________ ;(2)铁锈的主要成份_______________;(3)碘酒的溶剂__________________;(4)铁与稀盐酸反应生成的一种非气态物质______________。
25.铝是一种活泼金属,但在铝制品的表面常形成一层致密的____________保护膜,可阻止铝进一步氧化,反应的化学方程式为______________________________________________。铁制品生锈的实质是铁与_______________________________等共同作用,铁锈疏松,不能阻碍进一步反应,因此铁制品可以全部锈蚀。
26.将一份质量为200g的15%的氯化钠溶液的溶质质量分数增大一倍,你可以采取的措施有:(1)加入氯化钠固体____________g;(2)蒸发掉____________ g水。
27.有H2O、Fe、CuSO4、C等四种物质,请写出以它们其中一种或两种为反应物发生的化学反应,并按反应类型进行填写(每个2分):
(1)分解反应:_________________________________________________________
(2)化合反应:_________________________________________________________
(3)置换反应:_________________________________________________________
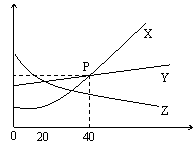
28.观察如图所示的X、Y、Z三种物质的溶解度曲线,回答问题:
|
(2)0℃~20℃时,X、Y、Z三种物质的溶解度大小
|
![]() (3)可以用升高温度、蒸发溶剂、加入溶质的方法
(3)可以用升高温度、蒸发溶剂、加入溶质的方法
|
(4)40℃时X的饱和溶液的溶质质量分数为_________;
(5)当X中混有少量Y时,可采取_____________________________方法提纯X。
三、我会分析(每空1分,共21分)
 29.杜刚同学查阅有关资料得到:钠是一种非常活泼的金属,将其投入水中,它会漂在水面上与水发生剧烈反应,放出大量的热,使自身熔化成银白色的小球,甚至使生成的氢气燃烧,其反应的化学反应方程式为:2Na+2H2O=2NaOH+H2↑,但它不与煤油
29.杜刚同学查阅有关资料得到:钠是一种非常活泼的金属,将其投入水中,它会漂在水面上与水发生剧烈反应,放出大量的热,使自身熔化成银白色的小球,甚至使生成的氢气燃烧,其反应的化学反应方程式为:2Na+2H2O=2NaOH+H2↑,但它不与煤油
|
|
|
![]()
![]() 煤油,然后用小刀切一块绿豆般大的钠放入烧杯的水中,钠会悬浮于水
煤油,然后用小刀切一块绿豆般大的钠放入烧杯的水中,钠会悬浮于水
与煤油的界面处,并发生反应,直到钠消失,溶液变成红色。请你回答下列问题:
(1)反应生成的氢气在钠附近不会燃烧。其原因是___________________________________。
(2)由以上事实可以得出钠具有的物理性质有____________________、__________________
____________________、_____________________________。
(3)若反应的钠的质量为0.46克,则生成的氢气有__________________克。
30.配制一种质量分数为5%的氢氧化钠溶液50克:(1)计算需要氢氧化钠________克,水________毫升(水的密度为1 g/cm3);(2)氢氧化钠具有腐蚀性,易吸收空气中水分,使其表面潮湿最终溶解,所以在称量氢氧化钠固体时应放在___________里称量。在下表中用“√”表示你所选用的砝码,在下图中用“△”表示游码在标尺上的位置,以此表示你的称量过程(假设你所用的盛放氢氧化钠的容器质量为35.3克);(8分)
| 砝码(g) | 50 | 20 | 20 | 10 | 5 |
| 取用情况 |

(3)量取你所需要的水量,倒入盛放有氢氧化钠的烧杯里,用_______________搅拌,使氢氧化钠溶解,若此时你用手触摸烧杯外壁,你会感到__________________,原因是____
______________________________________________________。
(4)小明同学进行量取水量操作时,俯视刻度,那么用他量取的水配制溶液将会导致溶液中溶质的质量分数____________(填“偏大”、“偏小”或“不变”)。
五、我会算(每小题6分,共12分)
32.用2%的氢氧化钠溶液给禽舍消毒能有效杀灭“禽流感”病毒,要配制8L2%的氢氧化钠溶液(密度为1kg/L),需要向10%的氢氧化钠溶液中加入多少水?
33.将一定质量的镁投入98克的稀硫酸中恰好反应完全,收集到的气体0.2克。求(1)参加反应的硫酸溶液的溶质质量分数;(2)反应后生成的溶液的溶质质量分数。