初三化学中考模拟试卷
可能用到的相对原子质量:Mg-24 O-16 H-1 Cl-35.5 Al-27 Fe-56
Na-23 S-32 C-12
第Ⅰ卷(选择题 共30分)
(一)选择题(每小题2分,共30分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
1.某药品说明书中标有:本品每克含碘150毫克、镁65毫克、锌1.5毫克、锰1毫克。这里的碘、镁、锌、锰是指
A.原子 B.分子 C.元素 D.离子
2.下列变化中都能产生热,其中主要由物理变化所生成热的是
A.电熨斗通电后生热 B.大量枯枝烂叶埋在地下发酵生热
C.生石灰遇水生热 D.电火花点燃氢气和氧气的混合气体生热
3.下列变化中,与其他三种变化有本质区别的是
A.木炭燃烧变成气体 B.碳酸氢铵加热变成气体
C.硫燃烧变成气体 D.干冰升华变成气体
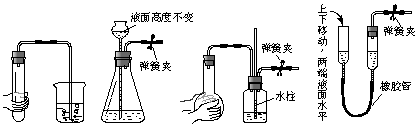 4.下列各图所示装置的气密性检查中,漏气的是
4.下列各图所示装置的气密性检查中,漏气的是
A. B. C. D.
5.食品卫生与身体健康密切相关。下列做法中的食品会对人体产生危害的是
A.用石灰水保存鲜蛋 B.用甲醛溶液浸泡海产品
C.在食盐中加入适量碘酸钾防治碘缺乏症 D.蒸馒头时加入适量的碳酸钠或碳酸氢钠
6.某化学兴趣小组,通过电解水的方法探究水的组成,他们通过化学方程式计算得知,生成的氢气和氧气的体积比为2︰1,但实验测得的数据中氢气和氧气的体积比略大于2︰1 。针对这发现,你认为下列做法不符合科学态度的是
A.反复多次实验查找原因 B.查找实验装置是否漏气
C.大胆提出假设:氧气比氢气更易溶于水
D.实验所得数据与理论值相差不多,可以认为实验己经成功
7.将一定质量的KNO3饱和溶液,从50℃冷却到10℃,溶液中保持不变的是
A.溶质的质量 B.溶剂质量 C.溶液质量 D.溶液中溶质的质量分数
8.氮气和氢气在一定条件下,能发生反应:N2+3H2 一定条件 2NH3,若用●表示氮原子,○表示氢原子,则上述反应可表示为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
9.酸、碱、盐的共同点是
A.都溶于水 B.都含有氧元素
C.都含有氢元素 D.都含有非金属元素
10.自来水生产过程中,通入氯气的目的是
A.除去易挥发的杂质 B.消毒杀菌 C.沉降泥沙 D.吸附悬浮物
11.BGO我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验。BGO是锗酸铋(化学式为Bi4Ge3O12)的简称。己知在BGO中锗(Ge)的化合价是+4价,则在BGO中铋(Bi)的化合价为
A.+2 B.+3 C.+4 D.+5
12.三硝酸甘油脂【C3H5(ONO2)3】是一种炸药,撞击发生爆炸,反应的化学方程式为:4C3H5(ONO2)3 == wN2 + xCO2 + yH2O +zO2,则化学计量数x、y之和为
A.8 B.12 C.22 D.32
13.铁丝在空气中灼热发红,但不能燃烧,而在纯氧中却能燃烧,这一事实与下列哪一因素关系最密切
A.铁丝的表面积 B.氧气的浓度
C.燃烧的温度 D.铁的着火点
14.如下图所示,下列四个容器中,装有不同比例的空气和二氧化碳,同时放在阳光下,过一段时间,我们可观察到U形管右侧b处上升最高的是
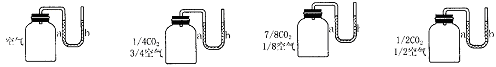 A.
B.
C.
D.
A.
B.
C.
D.
15.向HCl和FeCl3的混合溶液中,不断加入NaOH溶液,下图曲线正确的是
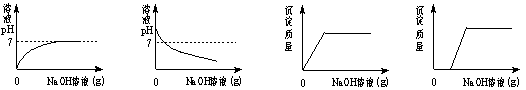 |
A. B. C. D.
A. B. C. D.
第Ⅱ卷(非选择题 共70分)
(二)(本题包括5小题,共16分)
16.(4分)用化学用语表示:
食盐水中的溶质是_________;地壳中含量最多的元素是_________;
3个氮原子__________ ;两个镁离子________。
17.(2分)高温烧制黏土砖时,当砖已烧成且窑温较高时,往砖上浇水得到的是青砖,而不浇水得到的是红砖。成砖的颜色主要是由砖中铁的氧化物决定的。青砖中所含铁的氧化物为
(填化学式),红砖中所含铁的氧化物为 (填化学式)。
18.(1分)已知磷的化合价有+3、+5、-3等。有一种谷仓杀虫的药剂叫磷化铝,其化学式为_______________。
19.(3分)小明的家乡经常出现水稻倒伏现象,他通过调查研究,发现主要原因是缺少 肥(填元素名称),他建议农民适量施用草木灰或者 (填化学式)。但是通过多施用草木灰会使土壤pH>7,显 性,不利于水稻生长。
20.(6分)在牙膏、化妆品、涂料中常用轻质碳酸钙粉末做填充剂。它通常由石灰石煅烧,先制得氧化钙,再将氧化钙用水消化为消石灰悬浊液,然后使净化后的消石灰悬浊液与二氧化碳反应制碳酸钙,经干燥、粉碎后即得产品。试用化学方程式表示上述反应原理:
① ;② ;③ 。
(三)(本题包括7小题,共22分)
21.(3分)随着高科技新材料技术的发展,新型工程塑料逐步取代钢、木、水泥三大传统建筑基本材料,精细陶瓷更以其抗高温、超强度、多功能等优良性能成为“先进”新型材料,工程塑料属于 ,精细陶瓷属于 (选填无机材料、合成材料)。请同学们结合生活、生产举一个利用复合材料的例子 。
22.(3分)根据你的生活经验和下表所提供的信息,分析并回答下列问题:
| 物理性质 | 物理性质比较 |
| 导电性 (以银为100) | 银 铜 金 铝 锌 铁 铅 |
| 100 99 74 61 27 17 79 | |
| 密度 (g·cm-3) | 金 铅 银 铜 铁 锌 铝 |
| 19.3 11.3 10.5 8.92 7.86 7.14 2.70 | |
| 熔点 (℃) | 钨 铁 铜 金 银 铝 锡 |
| 3410 1535 1083 1064 962 660 232 | |
| 硬度 (以金刚石为10) | 铬 铁 银 铜 金 铝 铅 |
| 9 4- 5 2.5-4 2.5-3 2.5-3 2-2.9 1.5 |
⑴为什么菜刀、锤子等通常用铁制而不用铅制 ;
⑵银的导电性比铜好,为什么导线一般用铜制而不用银制 ;
⑶为什么灯泡里的灯丝用钨制而不用锡制 。
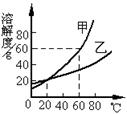 23.(4分)溶解度曲线为我们定量描述物质的溶解性强弱提供了便
23.(4分)溶解度曲线为我们定量描述物质的溶解性强弱提供了便
利,请你根据右图的溶解度曲线回答下列问题:
⑴ 20℃时,甲物质的溶解度 (填“大于”、“等于”或“小于”乙物质的溶解度;
⑵ ℃时,两物质的溶解度相等;
⑶ 60℃时,将80g甲物质放入100g水中,所得溶液的溶质质量分数为 ;
⑷ 若有一甲的溶液中混有少量乙要提纯甲可采用 方法。
24.(4分)有多方法可以鉴别水和酒精。请用两种方法区别水和酒精(要求说明实验方法、观察到的现象和结论)。
⑴ _____________________ ______
⑵ _____________________________ ___
25.(2分)某课外活动小组进行了如右图的气体性质实验,按从左至右顺序操作,小图中的序号是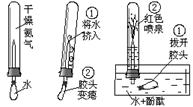 这一步的操作或出现的现象顺序。从图中现象可推断氨气的两个性质是:
这一步的操作或出现的现象顺序。从图中现象可推断氨气的两个性质是:
①________________ __;
②______________________ ___。
26.(4分)为下列实验各选用一种实验用品:
⑴ 释浓硫酸应当在_____中进行。
⑵ 检验溶液的酸碱度应当用_____________.
⑶ 检验可燃性气体的纯度时应当用_________盛装气体。
⑷ 存放石灰水应当用__________盛溶液。
27.(2分)右图是关于氢氧化钙溶解度随温度变化的实验。
⑴ U形管A处观察到_______________.
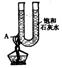 ⑵ 若移去酒精灯,溶液恢复到原来的温度,A处观察到_______________
⑵ 若移去酒精灯,溶液恢复到原来的温度,A处观察到_______________
(四)(本题包括2小题,共19分)
28.(6分)化学电池在通信、交通和日常生活中有着广泛的应用,但是,废弃电池所带来的环境污染问题也日益突出。已知镍镉(Ni—Cd)电池中发生的化学反应为:
Cd + 2NiO(OH) + 2H2O 2Ni(OH)2 + Cd(OH)2
其中,Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸。请回答:
⑴ 镍镉电池充电时,其能量的转化是由 能转变为 能;
⑵ 一节废镍镉电池会使1m2的耕地失去使用价值,在酸性土壤中,这种污染尤为严重。这是因为 。
⑶ 废弃的镍镉电池所产生的Cd2+污染,可导致人体患骨痛病及肝、肾、肺的病变,其中,Cd2+进入人体的途径如下图所示:
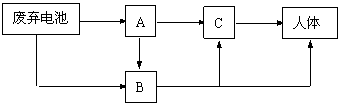 |
A、B、C代表Cd2+污染传递的载体,如果A代表土壤;则B代表 ;C代表 。
⑷ 你认为减少甚至消除废弃电池污染,应该采取的措施是 。
29.(13分)2005年3月的某一天,京沪高速公路淮安段发生重大交通事故,导致35 t液氯大面积泄漏,造成28人死亡,285人伤。氯气是一种黄绿色的有毒气体,密度比空气大,能溶于水,能与水发生化学反应生成盐酸和次氯酸(HClO),并能与碱反应,氯气被吸入人体后,会导致呼吸困难,甚至窒息死亡,事故发生后,附近居民被紧急疏散,戴防毒面具的消防人员不停地向空中喷射水幕及碱溶液,及时有效地控制了氯气的扩散,消防人员向空中喷射氢氧化钠溶液吸收氯气(反应原理:Cl2 + 2NaOH == NaCl + NaClO + H2O),就此回答下列问题。
⑴ 根据上述信息,请你写出氯气的两条物理性质: 、 ;⑵ 氯气向四周扩散,这一现象说明分子 ;
⑶ 消防人员所戴的防毒面具中的活性炭的作用是 ;
⑷ 实验室制取氯气反应原理是:MnO2 + 4HCl △ X + 2H2O + Cl2↑,X的化学式是 ;
⑸ 根据用氢氧化钠溶液来吸收泄漏出来的氯气化学方程式(其中NaClO是次氯酸钠,ClO-叫次氯酸根),试写出工业上以氯气和熟石灰为原料制取漂白粉的化学方程式:
;
⑹ 自来水厂经常用氯气作消毒剂,写出氯气与水反应的化学方程式:
。同时次氯酸具有漂白性,它可以将某些有色物质氧化成无色物质。某同学用滴管将饱和氯水(氯气的水溶液)逐滴滴入含有酚酞试液的的氢氧化钠溶液中,当滴到最后一滴时,红色突然褪去。红色褪去的原因可能有两种情况(用简要的文字说明):
① 。② 。
⑺ 若所用氢氧化钠溶液的质量分数为10%,试计算吸收35 t氯气,理论上至少需要消耗此溶液 t。(精确到0.1)
(五)(本题包括2小题,共13分)
30.(8分)过碳酸钠(Na2CO4)跟盐酸反应的化学方程式为:
 2Na2CO4+4HCl==4NaCl+2CO2↑+O2↑+2H2O在过碳酸钠商品中一般都含有Na2CO3,为测定它的纯度,取一定量的样品和盐酸反应,通过测定产生O2的体积,可以计算出Na2CO4的含量。
2Na2CO4+4HCl==4NaCl+2CO2↑+O2↑+2H2O在过碳酸钠商品中一般都含有Na2CO3,为测定它的纯度,取一定量的样品和盐酸反应,通过测定产生O2的体积,可以计算出Na2CO4的含量。
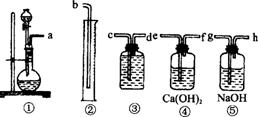
⑴ 根据上图提供的仪器,组装一套测定商品过碳酸钠纯度的实验装置,该套装置按接口字母的连接顺序是 。
⑵ 实验开始前,对整套装置必须进行的操作是 。
⑶ 装置④的作用是 。
⑷若在实验中称取1.22g样品进行测定,已知常温下O2的密度约为1.42g/L。实验室有50mL、100mL、150mL三种规格的量筒,该实验所用量筒的规格为 ,其理由是:
。
⑸正确读取量筒内液体体积的方法为: 。
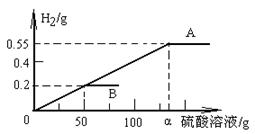 31.(5分)现有两块合金,一块是Fe、C合金,另一块是Mg、Al合金,分别取等质量(5.7g)的两块合金,与稀硫酸反应,产生气体的质量与所耗稀硫酸溶液的质量关系如右图所示,试根据图示进行分析,回答下列相关问题。
31.(5分)现有两块合金,一块是Fe、C合金,另一块是Mg、Al合金,分别取等质量(5.7g)的两块合金,与稀硫酸反应,产生气体的质量与所耗稀硫酸溶液的质量关系如右图所示,试根据图示进行分析,回答下列相关问题。
⑴A、B两曲线中,曲线 (填“A”或
“B”)是Mg、Al合金。
⑵该硫酸溶液50g中含硫酸 g。
⑶该Fe、C合金中铁的质量分数是 。
⑷α的值为 。(要求列式计算)