初三化学第二单元溶液的基础知识(A卷)
可能用到的相对原子质量:Ca-40 H-1 Cl-35.5 C-12 O-16 S-32 Zn-65
一、选择题(每小题只有一个选项符合题意)(40分)
1.下列物质加入水中,能得到溶液的是
A.米粉 B.酒精 C.花生油 D.泥土
2.在一定的温度下,某物质的饱和溶液一定是
A.很浓的溶液
B.很稀的溶液
C.不能继续溶解任何物质的溶液
D.不能溶解该溶质的溶液
3.影响固体溶解度的因素主要是
A.溶质的质量 B.溶剂的质量
C.温度的高低 D.压强的大小
4.下列物质的溶解度随着温度的升高而减小的是
A.氯化钠 B.氢氧化钙
C.硝酸钾 D.硝酸钠
5.下列说法正确的是
A.饱和溶液一定是浓溶液
B.不饱和溶液一定是稀溶液
C.饱和溶液一定比不饱和溶液浓
D.同温下氯化钠的饱和溶液一定比不饱和溶液浓
6.t1℃时的氯化钾溶液降温至t2℃时有晶体析出,则该溶液
A.溶剂量减少 B.溶质的质量不变
C.氯化钾的溶解度增大 D.为饱和溶液
7.一种溶液在加水稀释前后,下列各量不变的是
A.溶质的质量 B.溶液的密度
C.溶液的质量 D.溶质的质量分数
8.下列各组混合物可用溶解过滤蒸发的方法加以分离的是
A.硝酸钾中含有少量的氯化钠
B.氯化钾中含有少量的氯化钠
C.食盐中含有少量的泥沙
D.硝酸钾中含有少量的蔗糖
9.粗盐提纯时,将滤液放在蒸发皿中用酒精灯加热,当蒸发皿中出现何种情况时即停止加热
A.滤液开始沸腾时
B.水分全部蒸发完全
C.蒸发皿中出现少量固体
D.蒸发皿中出现多量的固体
10.欲使一种不饱和溶液转变为饱和溶液,最可靠的方法是
A.升高温度 B.再加入该溶质
C.降低温度 D.倒出些溶液
11.打开汽水瓶盖,有大量的气泡逸出,根据汽水中二氧化碳的溶解情况分析,下列叙述错误的是
A.溶质的质量减少
B.二氧化碳的溶解度减小
C.溶液的质量变轻
D.溶液从饱和变成不饱和溶液
12.从食盐和泥沙的混合物中,除去泥沙并得到纯净的食盐晶体,需经过:①过滤 ②溶解 ③蒸发结晶等几步操作。以下操作顺序正确的是
A.①②③ B.③①② C.②①③ D.②③①
13.实验室要用36%的浓盐酸配制10%的稀盐酸,实验时必不可少的一组仪器是
A.烧杯、量筒、温度计 B.玻璃棒、量筒、烧杯
C.天平、烧杯、玻璃棒 D.试管、药匙、烧杯
14.为了从硝酸钾与氯化钠(少量)的混合物中提取出硝酸钾,要采用的方法是
A.加热溶解、过滤
B.加热溶解、蒸发结晶
C.加热溶解、降温结晶
D.加热溶解、降温结晶、过滤
15.下列溶液为无色的是
A.FeCl2溶液 B.CuSO4溶液
C.KMnO4溶液 D.NaCl溶液
16.下列关于溶解度的说法,正确的是
A.20℃时,20克硝酸钾溶解在100克水里,所以20℃时,硝酸钾的溶解度是20克
B.20℃时,把20克硝酸钾溶解在水里制成饱和溶液,所以20℃时硝酸钾的溶解度是20克
C.20℃时把31.6克硝酸钾溶解在100克水里形成饱和溶液,所以硝酸钾的溶解度是31.6克
D.把31.6克硝酸钾溶解在100克水里,形成饱和溶液,所以硝酸钾的溶解度是31.6克
17.固体溶解度曲线上的任意一点表示
A.相应温度下,100克溶剂里最多溶解溶质的质量
B.一定温度和一定质量的溶剂里溶解溶质的质量
C.相应温度下,100克溶剂里能溶解溶质的质量
D.溶液达到饱和时溶解的溶质的质量
18.下列操作中正确的是
A.用酒精灯的外焰给试管加热
B.实验剩余的药品立即放回原试剂瓶
C.把称量物放在托盘天平的右盘上进行称量
D.在量筒里配制溶质质量分数一定的溶液
19.保持温度不变的条件下,蒸发去某硝酸钾溶液中的部分水,一定不变的是
A.溶质的质量 B.溶液的质量
C.硝酸钾的溶解度 D.溶质的质量分数
20.配制225克质量分数是20%的硫酸溶液,需量取质量分数是60%(密度是1.5 g·㎝-3)的稀硫酸体积是
A.45 ml B.50 ml C.35 ml D.67.5 ml
二、填空题 (42分)
21.写出下列溶液中溶质的化学式:
稀硫酸______澄清的石灰水______稀盐酸______酒精的水溶液______锌与稀硫酸完全反应后得到的溶液______铁与稀盐酸完全反应后得到的溶液________
22.(1)某温度下接近饱和的硝酸钾溶液,使其变成饱和溶液的方法是①______________②____________________③_________________。
(2)使饱和的石灰水变成不饱和的石灰水的方法是①_______________②_____________③________________
23.结晶的方法有________________和________________;
对于溶解度受温度影响不大的固体溶质,可用______的方法结晶;对于溶解度受温度影响相当大的固体溶质,可用______的方法进行结晶。
24.用“=”“<”或“>”号填空:
(1)50℃时熟石灰的溶解度________20℃时的溶解度。
(2)20℃时,100克水里溶解31.6克硝酸钾,则此时溶液中溶质的质量分数________31.6%。
(3)10%的食盐溶液100克,取出50克,剩下溶液溶质的质量分数________10%。
(4)50毫升酒精和50毫升水混合后体积_________________100毫升。
25.A、B、C三种物质的溶解度曲线如图所示:
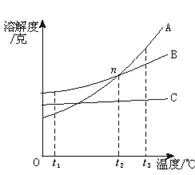
(1)t1℃时三种物质的溶解度大小顺序是_____________________________。
(2)t3℃时,A、B、C分别溶解在50克水中形成饱和溶液,冷却至t1℃时,析出晶体最多的是__________________。
(3)n点表示在t2℃时_______________________________________。
(4)为了从混有少量C物质的A中提取纯净的A,可采用的方法是______________。
(5)从C的溶液中提取C,最好采用_______法,而从A的热饱和溶液中提取A,则可采用_______法。
26.气温很高,气压较低的夏天,鱼常浮到水面上呼吸,这是由于_____________的缘故。打开汽水瓶盖时,常有大量气泡从瓶中涌出,这是由于______________________________。
27.填写下列实验时所需仪器的名称:
(1)装配过滤器时需用_____________________________________________________
(2)蒸发浓缩溶液时需用___________________________________________________
(3)向试管中滴加少量液体时用_____________________________________________
(4)量取少量液体时用_____________________________________________________
(5)溶解多量固体时常用___________________________________________________
28.某氯化钾溶液在20℃时不能继续溶解氯化钾,则该溶液是氯化钾的__________溶液;向其中加入少量的氯化钠能继续溶解,则该溶液是氯化钠的______________溶液。
29.配制溶质质量分数是12%的食盐溶液100克,通过计算后可用_______称量_______克食盐,再用_______量取_______毫升水,倒入已盛有食盐的_______中,并用_______搅拌溶液,静置后,移入_______,贴上标签,注明:12%的食盐溶液。
三、实验题(6分)
30.为配制100克质量分数是2.5%的氢氧化钠溶液,某同学进行如下的实验操作:
(1)称取2.5克氢氧化钠固体:在天平的两托盘上各放一张质量相同的纸片,调整天平到零点,然后在左盘上放2克砝码,游码拨至0.5克,往右盘加氢氧化钠固体至天平平衡。指出称量中的两处错误:
①__________________________________________________________________;
②__________________________________________________________________。
(2)配制溶液:用量筒量取100毫升水,然后将氢氧化钠固体加入量筒中的水里,边加边搅拌。指出配制中存在的两处错误及后果:
错误:①___________________________________
②___________________________________
后果:①___________________________________
②___________________________________
四、计算题(12分)
31.80克12%的硝酸钠溶液,(1)如果再加入20克水,溶液中溶质的质量分数是多少?
(2)如果再加入20克硝酸钠完全溶解后,溶液中溶质的质量分数是多少?
32.含碳酸钙80%的石灰石(所含杂质不溶于水,也不与稀盐酸反应)12.5克,与100克稀盐酸恰好完全反应。求:
(1)稀盐酸中溶质的质量分数。
(2)生成的氯化钙溶液中溶质的质量分数。
附:参考答案
一、1.B 2.D 3.C 4.B 5.D 6.D 7.A 8.C 9.D 10.B 11.D 12.C 13.B 14.D 15.D16.C 17.A 18.A 19.C 20.B
二、21.H2SO4 Ca(OH)2 HCl C2H5OH ZnSO4 FeCl2
22.(1)①加入硝酸钾至不再溶解
②降低温度至有晶体析出
③蒸发一定质量的水并冷却至原来的温度
(2)①加水
②降低温度
③通入一定量的二氧化碳气体
23.蒸发溶剂法 冷却热饱和溶液法 蒸发溶剂冷却热饱和溶液
24.< < = <
25.(1)B>C>A
(2)A
(3)A与B在该温度时溶解度相同
(4)冷却热的饱和溶液法
(5)蒸发溶剂 冷却热的饱和溶液
26.温度升高,压强减小时,氧气的溶解度减小,水中的溶解氧减少,鱼在水中呼吸困难,因而要浮在水面上呼吸 气压减小,CO2的溶解度变小,CO2从汽水中逸出
27.(1)漏斗、铁架台(铁圈)
(2)蒸发皿、酒精灯、玻璃棒、铁架台(铁圈)
(3)胶头滴管
(4)量筒
(5)烧杯
28.饱和溶液 不饱和溶液
29.天平 12 量筒 88 烧杯 玻璃棒 细口瓶
三、30.(1)氢氧化钠有腐蚀性,不能直接放在纸上称量,应放在玻璃器皿中称量 称量物与砝码放倒了位置,应把称量物放在左盘,砝码放在右盘
(2)量取的水偏多 配制溶液不能在量筒内溶解质量分数偏小 损坏量筒
四、31.(1)9.6% (2)29.6%
32.(1)7.3% (2)10.51%