九年级化学上学期能力检测

(命题人:王俊义)
成绩_______________
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 K-39 Cu-64 Fe-56 P-31
一、选择(每题1分,共18分。请将答案入下面的表格中)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
1.6000多年前,半坡居民所从事的生产生活中,发生了化学变化的是
A.建造土房 B.烧制土陶 C.磨制石器 D.用麻织布
2.将下面的物质分别放入水中,不形成溶液的是
A.白醋 B.食用油 C.食盐 D.酒精
3.下列人类做法中,不会造成环境污染的是
A.使用太阳能淋浴器 B.燃烧原煤 C.汽车尾气排放 D.工厂废水任意排放
4.下列各组物质中,前者为单质,后者为混合物的是
A.银、氯化钾 B.白磷、冰水混合物 C.水银、洁净的空气 D.铁粉、二氧化碳
5.葡萄糖(C6H12O6)是一种人体最易吸收的糖类物质,以下说法正确的是
A.它是由碳、氢、氧三种原子构成的 B.葡萄糖分子中含有水分子
C.葡萄糖充分燃烧后的产物只有CO2和H2O D.葡萄糖是一种混合物
6.钢铁工业是国家工业的基础,新中国成立后,我国钢铁工业得到飞速的发展。目前,我国钢产量已跃居世界首位。下列关于铁的说法,正确的是
A 铁桶可以用来盛装硫酸铜溶液。 B 生铁和钢都是铁的合金。
C 铁元素是地壳中含量最多的元素 D 铁在氧气中燃烧生成三氧化二铁
7.西汉刘安曾记载“曾青得铁则化为铜”。这里的“铜”是指
A.铜元素 B.铜单质 C.氧化铜 D.铜原子
8.“摇摇冰”是一种即用即冷的饮料,吸食时,只要将饮料罐隔离层中的物质与水混合后摇动,即可制冷。该物质可能是
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.生石灰
9.下列实验仪器中,不能用作反应容器的是
A.试管 B.烧杯 C.集气瓶 D.量筒
10.图书馆中图书档案资料等着火时,可用液态二氧化碳灭火器扑灭,液态二氧化碳灭火中的主要作用是
A.降低燃烧物的着火点 B.防止燃烧产物污染空气
C.降温和隔绝空气 D.分解出能灭火的物质
11.室温下饱和食盐水露置在空气中一段时间后,有少量的固体析出,因为:
A.氯化钠的溶解度变小 B.溶液质量分数变小
C.溶剂质量减少 D.溶液变为不饱和溶液
12.下列变化中属于分解反应的是
A.蒸发液态空气生成氮气和氧气 B.少许二氧化锰投入双氧水中制得氧气
C.酒精完全燃烧生成了水和二氧化碳 D.蔗糖溶于水形成糖水
13.我们的生活和生产离不开铁制品,但铁制品在一定的环境中容易生锈,为了防止铁生锈,在铁制品表面,不宜采用的方法是
A.刷一层油漆 B.涂一层油 C.镀一层其它金属 D.随时用水冲洗
14.下列有关实验现象描述正确的是
A.铁丝在空气中被点燃,火星四射,生成一种黑色的固体
B.氢氧化钠溶液中滴加硫酸铜溶液,产生白色沉淀
C.把光亮的铜片放入盐酸中,表面出现气泡
D.将大量生石灰放入水中,发现水沸腾
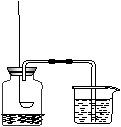 15.下列实验操作图或装置图中正确的是
15.下列实验操作图或装置图中正确的是
 | |||||
 | |||||
 | |||||
A.液体加热B.制取收集二氧化碳C.用高锰酸钾制氧气 D.测定空气成分
16.下列叙述正确的是
A.不同元素的根本区别是在与其相对原子质量不同
B.一种元素只能组成一种单质
C.某单质与氧气完全反应后得到的产物一定含有氧化物
D.原子一定是由质子和中子构成的
17.人体中化学元素含量的多少,会直接影响到人体的健康。下列元素中,因摄入量不足容易导致人患骨质疏松症的是
A.铁 B.碘 C.钙 D.锌
18.在抢救病人时,常需用静脉点滴输入0.9%的氯化钠溶液,这是由于人体血液中的“矿化度”(即无机盐的相对含量)为0.9%。另有研究证明,30亿年前地表原始海水的矿化度为0.9%。对此,下列猜测或评论中不足取的是
A.人类祖先可能是从原始海洋中逐渐进化到陆地上的
B.人体血液和原始海水的矿化度均为0.9%,纯属巧合,无任何科学价值
C.人体血液中,仍然带有着原始海水的某些印痕
D.人体血液和原始海水之间也许存在着某些尚未被认识的关系
二、填空(每空1分,共34分)
19.(1)“侯氏制碱法”的反应原理为:NH3+CO2+H2O+NaCl==NaHCO3↓+A,则A为___________(填化学式),A中氮元素的化合价为_________。
(2)请选用C、H、O、Ca四种元素中的一种或者是几种写出符合下列要求的化学式:
①打开汽水瓶盖时,大量逸出的气体__________;
②我国建设的“西气东输”工程中,这里的“气”指的是___________;
③在抢救危急病人时用的单质气体是______;
④相对分子质量最小的氧化物___________。
20.用数字和化学符号表示。
2个钠离子__________;
3个氢氧根离子_________;
保持氮气化学性质的最小微粒________;
碳酸钠中碳元素的化合价为+4价__ ___________;
21. 请用化学方法除去下列各组物质中括号中的物质。
(1)铜粉(铁粉)_______________________________________________
(2)一氧化碳(二氧化碳)_______________________________________;
22.(1)实验室现有质量分数为10%的NaOH溶液100g,由于实验要求,急需一定量的20%的NaOH溶液,我们可以往10%的溶液中加入NaOH固体________g,或者蒸发水________g均可达到目的。
(2)现有t℃下200g某物质的溶液,若蒸发掉20g水后,析出固体为5g,若蒸发30g水,析出固体为15g,则在t℃下该物质的溶解度为____________g。
23.金属材料在生活中普遍使用。铁制品表面的锈要及时除去,这是因为铁锈结构___________,会加快铁制品的生锈。铝制品不需要除锈,这是因为铝表面能形成_____________,可以阻止铝进一步氧化。
24.在赤壁之战中,周瑜的军队点燃战船,熊熊燃烧的战船借助东风直冲曹军的大船,使曹军的木船燃起大火,根据我们学过的燃烧条件的填写:曹军的木船是_______________,木船燃烧的条件是______________、_____________。
25.写出下列反应方程式。
(1)铁在氧气中燃烧
(2)煅烧石灰石
(3)古代湿法炼铜的原理
(4)用高锰酸钾制氧气
26.下表是硝酸钾和氯化钠两物质在不同温度下的溶解度
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 硝酸钾g | 13.3 | 20.9 | 36 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| 氯化钠g | 35.5 | 35.8 | 36 | 36.3 | 36.6 | 36.9 | 37.3 | 37.7 | 38.4 | 39 | 39.9 |
(1)由溶解度表格可知:两物质的溶解度受温度影响较小的是____________;当温度________℃时,硝酸钾的溶解度大于氯化钠的溶解度。
(2)若硝酸钾中混有少量的氯化钠,可采取__________方法提纯KNO3。在90℃时,若有1000g饱和的硝酸钾溶液,则该饱和溶液溶质质量分数为_______。
27.根据下表填空
| 气体 | 二氧化氮 |
|
| 颜色 | 棕色 | 无色 |
| 溶解性 | 易溶于水 | 微溶于水 |
| 反应 | 3NO2+H2O==2HNO3+NO | |
(HNO3,即硝酸,是化学常见的强酸之一,易溶于水)
如图所示,将一支充满二氧化氮的棕色气体的试管倒立在水槽中,试描述试管内可能出现的实验现象。①__________________________________________
②__________________________________________。
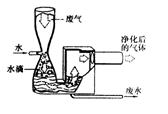 28.随着工业与交通运输业的迅速发展,有害气体和烟尘的排放,对空气造成了严重的污染,控制大气污染的主要途径是减少排放(1)曾经有过一段时间,许多工厂试图通过建造很高的烟囱来解决排放问题,然而这样做并没有达到目的,原因是
。如今,他们通过在烟囱中安装了过滤装置,可以有效地控制________的排放;安装烟囱净化洗涤装置(如图所示)可以除去废气中部分有害气体,根据该装置的净化原理分析,被除去的有害气体所具有的共同性质是_______________。
28.随着工业与交通运输业的迅速发展,有害气体和烟尘的排放,对空气造成了严重的污染,控制大气污染的主要途径是减少排放(1)曾经有过一段时间,许多工厂试图通过建造很高的烟囱来解决排放问题,然而这样做并没有达到目的,原因是
。如今,他们通过在烟囱中安装了过滤装置,可以有效地控制________的排放;安装烟囱净化洗涤装置(如图所示)可以除去废气中部分有害气体,根据该装置的净化原理分析,被除去的有害气体所具有的共同性质是_______________。
(2)按规定汽车应安装尾气处理装置,如在排气管上安装催化转化装置,使尾气中的一氧化碳与一氧化氮在催化剂的作用下,转化为二氧化碳和氮气,该反应的化学方程式为 __________ _________________。
三、实验探究(每空1分,共40分)
29.化学实验操作中,有很多步骤是需要有“先”与“后”,对化学实验结果、师生安全等具有十分重要的意义。我们在进行化学实验时,若遇到下列情况,应如何操作。
例:给试管中的药品加热,必须先预热,后集中加热;
(1)点燃可燃性气体(如氢气等)时,都要先_____________,后点燃;
(2)CO还原Fe2O3实验结束时,要先______________,后___________________。
(3)类似情况,请你再举出一例:________________________,要先 ,后 。
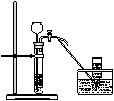
 30.根据下图所示的实验装置图回答:
30.根据下图所示的实验装置图回答:
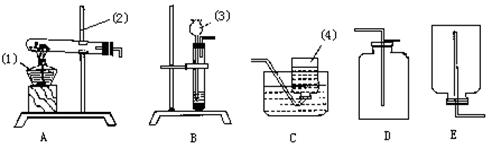 (1)写出有编号的仪器名称:
(1)写出有编号的仪器名称:
①_______________;②______________;③_____________;④____________。
(2)实验室用高锰酸钾制氧气应选用的发生装置是_____,收集装置_________。
(3)实验室制取二氧化碳时应选用的发生装置是______,收集装置为________。
(4)装置B可制取的气体除了上述的气体之外,还有_____________等。
(5)实验室用块状固体硫化亚铁(FeS)与稀硫酸反应制取硫化氢(H2S)气体,硫化氢气体的密度比空气的密度大,能溶于水。根据以上知识推断:实验室制取硫化氢气体应选用的发生装置为____________,收集装置为______________。
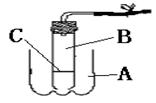 31.某学生利用废弃的可乐瓶和底部有小孔的试管组成制取二氧化碳的装置(如下图所示)。
31.某学生利用废弃的可乐瓶和底部有小孔的试管组成制取二氧化碳的装置(如下图所示)。
(1)该装置A应盛放 ,
B处应放进 ,
C应该是用 (A、铁丝B、塑料、C、铝丝) 为材料做的带孔的网(或有孔的板),放置C以后使该装置具有使反应随时发生或随时停止的优点。
(2)若C是用铁丝做的网,那么发生的后果是 ,其原因是 。
(3)若使正在发生的反应停止,可以通过操作 来实现,可看到的现象是 。
32.很多的成语与我们所学的化学知识有关。例如:
百炼成钢 (将反复烧红的生铁在空气中不断锤打,转化为钢。)
釜底抽薪 (釜:古代炊具,相当于现在的锅;薪:指柴火。)
请你选择其中一个,简述其中的化学原理。
你选择的成语是 。
其中的化学原理: 。
33.当学完溶液的性质的相关内容,我们了解到了某些溶液能够导电,老师就留下了一道思考题:溶液导电的原因是什么?同学开始了讨论,假设有很多:
同学甲:我认为,溶液形成时,构成物质的微粒被分散到溶液中,可以自由移动的缘故。
同学乙:某些物质是由离子构成的,离子是带电的微粒,我觉得这正是溶液导电的原因。
请问,你的假设是__________________________________________________。
请你设计具体的对比实验,证明你的假设正确性(填写缺少的仪器及试剂)
实验仪器:____________、导线若干、小灯泡、电池组、石墨电极、玻璃棒。
实验试剂:____________、蔗糖固体、食盐固体。
实验步骤:(完成表格中的空白)
| 实验步骤 | 实验现象 | 实验结论 |
| 正确连接电路,将石墨电极放入蔗糖溶液中 | 蔗糖微粒分散在水中不能导电 | |
| 小灯泡不亮 | 由离子构成的物质,离子不能自由移动不能导电 | |
| 正确连接电路,将石墨电极放入食盐溶液中 | 小灯泡亮了 | |
| 总结:溶液导电的原因是:_________________________________________________________________。 | ||
34.生活中处处有化学,小强把学到的化学知识用于生活中,进行下列探究。
(1)小强在化学课上知道了鸡蛋壳的主要成分是碳酸钙,决定制作一个“无壳鸡蛋”送给妈妈。他应从厨房中选择鸡蛋和________________。
 (2)如右图所示,小强把一只新鲜鸡蛋放入盛水的玻璃杯中,鸡蛋沉入水底(蛋壳的主要成分是碳酸钙)。回答下列问题:
(2)如右图所示,小强把一只新鲜鸡蛋放入盛水的玻璃杯中,鸡蛋沉入水底(蛋壳的主要成分是碳酸钙)。回答下列问题:
若向杯中逐渐加入食盐粉末直至溶液饱和(饱和食盐水的密度大于鸡蛋的密度),将会观察到什么现象?
___________________________________________________
原因是:
________________________________________________________________________________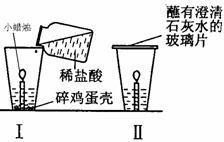
(3)小强同学在家里做了如图所示的小实验,根据图示实验回答以下问题:
①图Ⅰ中观察到的主要现象是___________________。由此得出有关CO2性质的结论是__________________。并依此性质确定的一个主要用途是_______________。
②当蜡烛熄灭后,在玻璃杯口迅速盖一块蘸有石灰水的玻璃片(见图Ⅱ)。观察到的现象是_________________________________。
四、计算(8分)
35.(3分)磷酸二氢钾(KH2PO4)大晶体应用于我国研制的巨型激光器“神光二号”中。试计算:
(1)磷酸二氢钾的相对分子质量为______________;
(2)多少千克的磷酸二氢钾与43.5kg硫酸钾中含钾量相等。
36.(5分)某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
| 甲 | 乙 | 丙 | |
| 稀硫酸 | 200g | 150g | 150g |
| 加入的铁样品 | 8g | 8g | 10g |
| 产生氢气质量 | 0.2g | 0.2g | 0.2g |
请你认真分析数据,回答下列问题:
(1)哪位同学所取用的稀硫酸与铁样品恰好完全反应 ;
(2)计算样品中铁的质量分数?
(3)计算恰好完全反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
 一氧化氮
一氧化氮