九年级化学试卷
(本卷满分100分,考试时间:90分钟)
相对原子质量:H:1 ,C:12,N :14,O:16,Na:23,Cl:35.5,Mg:24,Zn:65,Fe:56,Cu:64
第一部分 选择题(共40分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共30分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
1. 下列对各种材料的开发利用过程中,主要过程属于化学变化的是
A.用棉、麻等植物纤维纺纱织布 B.用钛和钛合金制成飞机、火箭的外壳
C.用砂子、石灰石和纯碱等为原料生产各种玻璃 D.用铝箔制成各种形状的制品
2. 野外旅行时,根据季节可以带上“即热饭盒”或“化学冰箱”。“化学冰箱”即把一种化学试剂放入容器中,加一定量的水,就可以形成低温小环境,这种试剂可以是下列物质中的
A.硝酸铵 B.浓硫酸 C.固体氢氧化钠 D.食盐
3.英国泰晤士河曾是世界上最脏臭的河流之一。由于执行了严格的污水排放制度、重建了水道体系和用专门船只向河水里输送某种气体等措施,河水水质己得到显著的改善。这里的“某种气体”是指
A.氢气 B.氯气 C.氧气 D.二氧化碳
4.有机高分子合成材料的出现是材料发展史上的重大突破,下列属于有机高分子合成材料的一组是
①家用保鲜袋 ②不锈钢 ③淀粉 ④尼龙布 ⑤汽车轮胎
A.①④⑤ B.②③④ C.②③⑤ D.①④
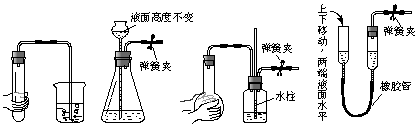 5.下列各图所示装置的气密性检查中,漏气的是
5.下列各图所示装置的气密性检查中,漏气的是
A B C D
6.为使2008年北京奥运会办成“绿色奥运会”,某校同学提出下列建议:①开发新清洁能源,减少化石燃料的燃烧;②开发生产无汞电池;③分类回收垃圾;④提倡使用一次性发泡塑料餐具和塑料袋;⑤提倡使用手帕,减少餐巾纸的使用;⑥推广使用无磷洗涤剂;⑦控制化肥和农药的过量使用。你认为可以采纳的是
A.①②③④⑥⑦ B.②③④⑤⑥⑦ C.①②③⑤⑥⑦ D.全部
7.1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了下面的实验。他们用一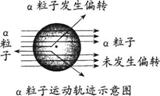 束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。由此推出关于原子内部结构的一些假设不合理的是
束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。由此推出关于原子内部结构的一些假设不合理的是
A.原子核体积很小 B.原子是一个实心球体
C.原子核与α粒子带同种电荷 D.原子内有相对较大的空间
8.在配制10%NaCl溶液的过程中,导致溶液中NaCl质量分数小于10%的可能原因是:①用量筒量取水时仰视读数②配制溶液时烧杯用少量水润湿③在天平的左盘称量氯化钠时,游码不在零位置就调节天平平衡,然后将游码移动到读数④盛装溶液的试剂瓶用蒸馏水润洗⑤氯化钠晶体不纯
A. ①②③④⑤ B. ①②④⑤ C. ①②③ D. ②③④⑤
9.多数食品容易吸收空气中的水分变潮湿,并与空气中的氧气反应而腐败。生产上多在食品中放入一小包CaO粉末,可使食品保持干燥。现已研究成功在食品中放入一小包铁粉(包裹在多孔泡沫中),铁粉吸收水分和氧气变为铁锈,从而保护食品。下列说法不正确的是
A.生成的铁锈是一种混合物 B.铁粉干燥剂能与水和氧气发生化学反应
C.也可选择浓硫酸作食品干燥剂 D.每种干燥剂袋上都要有明显的“勿食”字样
10.以下验证“盐酸中哪种粒子使紫色石蕊试液变红色”的实验设计不合理的是
|
|
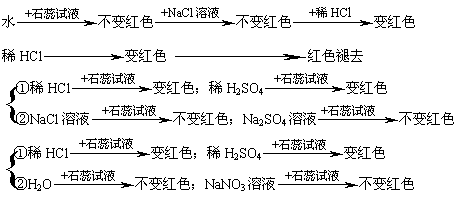 A.
A.
B.
C.
D.
11.金属X、Y、Z分别是Fe、Al、Cu、Ag中的一种。其中X能与稀H2SO4反应生成X2(SO4)3,而Y、Z不能与稀H2SO4反应,Y能与AgNO3溶液反应,而Z不能与AgNO3溶液反应。则X、Y、Z依次为
A.Fe、Ag、Cu B.Fe、Cu、Ag C.A1、Cu、Ag D.Al、Ag、Cu
12.过氧乙酸可以起到消毒作用,其分子结构如右图所示。有关过氧乙酸的叙述不正确的是
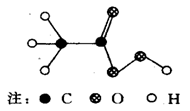 A.化学式为C2H4O3
A.化学式为C2H4O3
B.相对分子质量为76
C.完全燃烧生成CO2和H2O
D.C、H、O三种元素的质量比为3:1:4
13. 将一定量铝粉和氧化铜混合加热,反应的化学方程式为:3CuO+2Al=3Cu+Al2O3,反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是
①加入稀硫酸后,有气泡生成;②加入稀硫酸后,没有气泡生成;③加入稀硫酸后,溶液中有红色不溶物质;④插入溶液中的铁片表面有红色物质析出
A.只有④ B.②③ C.③④ D.①③④
14.在已调平的天平两端各放一个等质量的烧杯,向烧杯中各注入质量相等、溶质质量分数也相等的足量稀硫酸。在左边烧杯中投入一定质量的金属X粉末,同时在右边烧杯中投入与X等质量的金属Y粉末。观察到天平的指针先偏向左边,当两种金属完全溶解后,天平的指针偏向右边。则X、Y是下表组合中的
| A | B | C | D | |
| X | Mg | Zn | Zn | Fe |
| Y | Fe | Mg | Fe | Zn |
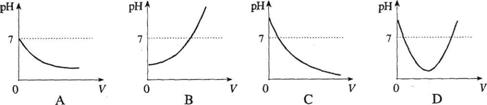 15.在A溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加B溶液,当滴至A、B两物质正好完全反应时,溶液呈紫色;再继续滴加B溶液时,溶液呈红色。在上述过程中,溶液的pH(纵坐标表示)与滴加B溶液的体积V(横坐标表示)之间的变化示意图是
15.在A溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加B溶液,当滴至A、B两物质正好完全反应时,溶液呈紫色;再继续滴加B溶液时,溶液呈红色。在上述过程中,溶液的pH(纵坐标表示)与滴加B溶液的体积V(横坐标表示)之间的变化示意图是
二、选择题(每题1个或2个选项符合题意,将其序号填入下表,每题2分,共10分,若少选该题得1分,若错选该题不得分)
| 题 号 | 16 | 17 | 18 | 19 | 20 |
| 答 案 |
16.下列各组溶液,不加其他试剂就能鉴别出来的是
A.CuCl2 NaOH NaNO3 BaCl2
B.Na2SO4 BaCl2 KNO3 NaCl
C.NaOH Na2SO4 FeCl3 BaCl2
D.K2CO3 BaCl2 HCl Na2SO4
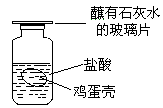 17.小艺在家里用鸡蛋壳与盐酸反应,证明鸡蛋壳里是否含有
17.小艺在家里用鸡蛋壳与盐酸反应,证明鸡蛋壳里是否含有
CO32-(装置如右图所示),实验后小王进行了如下归纳与推测,
其中正确的是
A.若有气泡产生且玻璃片上出现浑浊,说明鸡蛋壳里
可能含CO32-
B.能与盐酸反应产生大量气体的物质中一定含CO32-
C.若玻璃片上的石灰水没有变浑浊,说明鸡蛋壳里没有CO32-
D.若玻璃片上的石灰水没有变浑浊,有可能是盐酸的浓度过大
18.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
| 物 质 | A | B | C | D |
| 反应前质量/g | 19.7 | 8.7 | 31.6 | O.4 |
| 反应后质量/g | 待测 | 17.4 | 0 | 3.6 |
下列说法正确的是
A.物质c一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7g
C.反应过程中,物质B与物质D变化的质量比为87:36
D.若物质A与物质C的相对分子质量之比为197:158,则反应中A与C的化学计量数之比为2:l
19.利用化学实验可以鉴别生活中的一些物质。下表中各组物质的鉴别方法能将本组待鉴别的物质都区分出来的是
| 待鉴别物质 | 鉴别方法 | |
| A | 硬水、软水 | 加肥皂水,搅拌,观察产生泡沫的多少 |
| B | N2、02、C02、空气 | 用燃着的木条检验,观察木条燃烧情况 |
| C | 棉纤维、羊毛纤维、涤纶 | 闻燃烧产生的气味,观察燃烧情况和灰烬 |
| D | 氯化钾、硫酸钾、磷矿粉【Ca3(PO4)2】 | 看外观,再加水,观察是否溶于水 |
20.“绿色化学”是当今社会提出的一个新概念,在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%。在用C3H4(丙炔)合成C5H8O2(2—甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物可能是
A.CO2和H2O B.CO和CH3OH C.H2和CO D.CH3OH和H2
第二部分 非选择题 (共60分)
三、填空题(每空1分,共27分)
21.用正确的化学符号填空。
(1) 1个汞原子 ; (2) 2个氮分子 ;
(3) 3个铵根离子 ; (4)一种红褐色的固体 ;
(5) 碳酸钠中碳元素的化合价 ; (6)澄清石灰水中的溶质 。
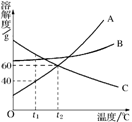 22.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
22.溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据右图的溶解度曲线回答下列问题:
(1) t1℃时,A、B、C三种物质的溶解度由大到小的
顺序是 ;
(2) 当A中混有少量B时,可用
方法提纯A;
(3) 在t1℃时,将25 g A物质加入到盛有50 g水的烧
杯中,充分搅拌,再升温至t2℃(不考虑溶剂的挥发),在升温过程中,A溶液中溶质的质量分数的变化情况是 。
23.某校食堂中餐食谱如下:
主食:大米饭
配菜:红烧排骨 煎鸡蛋 炸鸡腿 豆腐汤 炒猪肝
主食和配菜中主要含维生素、__________、_________、__________、无机盐和水等营养素,考虑到各种营养成分的均衡搭配,应该增加的配菜是_____________。
24.除去下列括号内的杂质(用化学方程式表示)
⑴ CO2(CO) ,
⑵ NaCl(Na2SO4) ,
⑶ Cu(Fe) ,
25. 2006年3月底,邻近昆明市郊的安宁突发森林大火,在灭火中消防官兵们使用了各种灭火措施,其中在山高坡陡的火场使用了灭火弹(如图所示)。
2006年3月底,邻近昆明市郊的安宁突发森林大火,在灭火中消防官兵们使用了各种灭火措施,其中在山高坡陡的火场使用了灭火弹(如图所示)。
灭火弹是一种无雷管、无炸药的安全消防器材,以超导材料引燃,使用时,揭开上端封皮,使超导热感应材料外露,用力投入火场,遇火瞬间,弹体裂开,释放出超细干粉高效灭火剂。灭火剂的有效成分是碳酸氢钠,其受热即分解产生大量二氧化碳气体,同时有碳酸钠和水生成。
(1)灭火弹的灭火原理是 ;
(2)灭火弹在脱离人手后能够飞向火场,是因为其具有 ;
(3)在灭火中,消防队员还使用了手持式风力灭火机,它以汽油为燃料,喷出类似十二级风的高速气流,将火吹灭。灭火机的灭火原理是
;
(4)消防队员在灭火中常被烤得难以忍受,需要不断往身上浇水。“浇水能降温”的道理是 。
26.用氯气或液氯消毒饮用水时,会和水中的有机物发生反应,生成对人体有毒的有机物。因此,世界环保联盟将全面禁止用氯气对饮用水消毒,建议推广采用安全、高效杀菌消毒剂ClO2。ClO2 是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解。ClO2易与碱反应,其杀菌、漂白能力均优于Cl2,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的气味。
(1)根据以上信息,请你总结出ClO2的性质:
物理性质 (写一点,下同);化学性质 。
(2)制取ClO2的方法有多种,目前欧洲一些国家用NaClO3氧化浓盐酸制取ClO2(Kestiog法),反应的化学方程式为:2NaClO3+4HCl = 2ClO2↑+ Cl2 ↑+ 2H2O + 2NaCl。我国最近研究成功用氯气氧化亚氯酸钠NaClO2(N2保护下)制取ClO2,同时生成生活中一种常见的盐,该反应的化学方程式是__________________________________________________;此法与Kestiog法相比,其优点是________________________________________________。
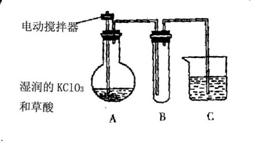 (3)工业上也可以在60℃时,用稍加潮湿的KClO3与草酸(HOOCCOOH)反应制取ClO2。某实验小组用右图所示装置制取并收集ClO2,在装置图中A为ClO2的发生装置,B为ClO2的收集装置,C为尾气吸收装置。请问:
(3)工业上也可以在60℃时,用稍加潮湿的KClO3与草酸(HOOCCOOH)反应制取ClO2。某实验小组用右图所示装置制取并收集ClO2,在装置图中A为ClO2的发生装置,B为ClO2的收集装置,C为尾气吸收装置。请问:
①为了保证实验成功,在A装置外面需加
、B装置外面需加 ;
②C中所盛放的药品是 。
四、实验与探究(每空1分,共27分)
27.小军以木条为基本原料,进行了如下一系列探究实验:
⑴ 对木条组成的探究:
| 实验操作 | 实验现象 | 实验结论 | 方法提炼 |
| 点燃干燥的木条,在火焰上方罩一干燥的冷烧杯 | 一会儿烧杯内壁有水雾产生。 | 木条中一定含有 元素 | 根据实验 可以推测出实验结论。 |
| 继续把火焰靠近烧杯底部 | 一会儿烧杯底部出现一层黑色物质 | 木条中一定含有 元素 |
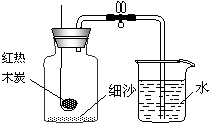 ⑵ 小军根据燃烧红磷测定空气中氧气含量的实验原理,认为可用木条燃烧产生的木炭代替红磷测定空气中氧气的含量,并按右图装置进行实验。
⑵ 小军根据燃烧红磷测定空气中氧气含量的实验原理,认为可用木条燃烧产生的木炭代替红磷测定空气中氧气的含量,并按右图装置进行实验。
①依据的实验原理是
。
小军检查装置气密性后,将盛有足量红热木炭的燃烧匙迅速伸入集气瓶中,并把塞子塞紧,待红热的木炭熄灭并冷却至室温后,打开弹簧夹,并未发现倒吸现象。
经过认真分析,小军发现实验失败的原因是(答一条) 。
② 小军将集气瓶中的细沙改为一种溶液,重复上述①实验,有倒吸现象,写出能体现该溶液作用的化学方程式: 。
小军还发现倒吸的水量未达到集气瓶内原剩余容积的1/5。原因可能是(答一条) 。
③ 小军反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择或生成物的要求上应考虑的是(答一条) 。
28.神舟六号载人飞船成功返航,标志着我国已跨入航天领域国际领先行列。某研究性学习小组查阅资料得知,宇宙飞船中可用超氧化钾(KO2)作为氧气再生剂。超氧化钾是一种固体,它与人呼出的二氧化碳反应生成氧气:4KO2 + 2CO2 == K2CO3 + 302
为了验证这个反应能够产生氧气,该小组同学以大理石和盐酸反应生成的CO2来与KO2反应制取02,设计了如下实验装置:
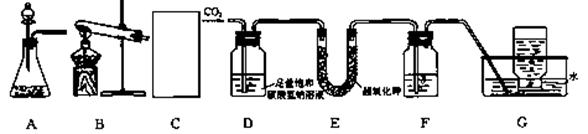
(1)C处应从A、B两种装置中选择 作CO2发生装置。检验G中集气瓶内收集的气体是否为氧气,可以在取出集气瓶后,用 检验。
(2)已知CO2不溶于饱和碳酸氢钠溶液,D装置的作用是 。
(3)为了除去O2中可能混有的CO2,F中可盛放过量 溶液。
(4)有同学提出,上述实验能生成氧气可能与CO2中混有的水蒸气有关。若要检验干燥的CO2能否用超氧化钾反应生成氧气,你对上述实验装置的改进方法是
。
29.蔬菜基地在种植蔬菜时,常采用下列方法:
(1)施用适量的氮肥可以使种植的蔬菜叶色浓绿。下列化肥中,属于氮肥的是 。
A.尿素[CO(NH2)2] B.草木灰 [主要成分K2CO3] C.磷矿粉 [主要成分Ca3(PO4)2]
(2)用大棚种植蔬菜时,常向大棚中补充气体肥料CO2。
①目的是促进绿色植物 作用。
②若提供的是工业CO2中混有少量的SO2,为了除去SO2,现设计以下两种方法:
甲方法:将气体通过足量的氢氧化钠溶液。 乙方法:将气体通过足量的碳酸氢钠溶液。
[提供资料]:Ⅰ.CO2 与 NaHCO3 不会发生反应。
Ⅱ.SO2 +2 NaHCO3 ==Na2SO3 + + H2O +2 CO2
Ⅲ.SO2 + 2NaOH == Na2SO3 + H2O
请你利用提供的资料和所学的知识分析:
上述 方法(填“甲”或“乙”)可行,理由是 。
(3)现有碳酸氢铵、硫酸钾两种固体化肥,请设计两种实验方法将它们加以区别。
| 方 法 | 现 象 | 结 论 |
| ① | 原化肥是碳酸氢铵 | |
| ② | 原化肥是碳酸氢铵 |
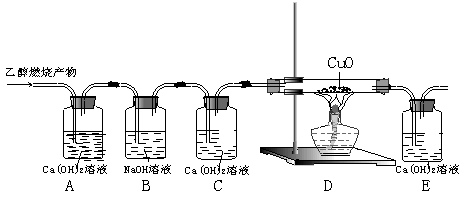
30.乙醇(C2H5OH)是以高粱、玉米、薯类等为原料,经过发酵、蒸馏制得,属于可再生资源。乙醇在足量的氧气中完全燃烧时生成二氧化碳和水,如果氧气不足,乙醇燃烧可能还有一氧化碳生成。现用下图实验装置进行实验,检验乙醇的燃烧产物中是否有二氧化碳和一氧化碳:

请回答下列问题:
(1)写出乙醇在足量的氧气中完全燃烧的化学方程式 。
(2)有甲、乙、丙三个同学分别完成上述实验并将观察到的现象填写在下表中,试用“有”、“没有”和“可能有”填写下表中的实验结论。
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 石灰水变浑浊 | 石灰水没变浑浊 | 石灰水没变浑浊 | 有 | |
| 乙同学 | 石灰水变浑浊 | 石灰水变浑浊 | 石灰水变浑浊 | ||
| 丙同学 | 石灰水没变浑浊 | 石灰水没变浑浊 | 石灰水变浑浊 | 有 | |
(3)若燃烧一定量的乙醇,得到4.4g二氧化碳和5.6g一氧化碳,在该反应过程中生成水的质量是 。
五.计算题(共6分)
![]() 31.氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl + 2H2O Cl2 ↑+ H2 ↑+
2NaOH
31.氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl + 2H2O Cl2 ↑+ H2 ↑+
2NaOH
现取一定质量的溶质质量分数为10%的氯化钠溶液进行
电解,当氯化钠完全反应时,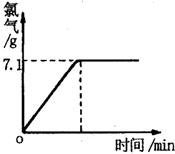 停止通电。生成氯气的质量与
停止通电。生成氯气的质量与
时间的关系如右图所示。
请计算:(1)参加反应的氯化钠是多少克?生成氢
气多少克?(2)反应后所得溶液中溶质的质量分数是
多少?(计算结果精确到0.001)
化学参考答案
一、选择题(每小题只有一个选项符合题意,每小题2分,共30分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | A | C | D | D | C | B | A | C | D | C | D | A | D | c |
二、选择题(每题1个或2个选项符合题意,将其序号填入下表,每题2分,共10分)
| 题 号 | 16 | 17 | 18 | 19 | 20 |
| 答 案 | D | A D | A | A C | B C |
三、填空题(每空1分,共27分)
+4
21.Hg,2N2、3NH4+、Fe(OH)3,Na2CO3,Ca(OH)2
22.⑴CBA,⑵降温结晶,⑶先变大后不变(或由28.6%增大至33.3%后不变)
|
24.⑴CO+CuO===Cu+CO2 ⑵Na2SO4+BaCl2=BaSO4↓+2NaCl
⑶Fe+H2SO4=FeSO4+H2↑或Fe+CuSO4=FeSO4+Cu
25.(1)灭火弹产生的二氧化碳不可燃,不支持燃烧,覆盖在燃烧物上,隔绝了空气
(2)惯性
(3)大量冷风带走热量,使燃烧物温度降到着火点以下
(4)水蒸发吸热
26.(1)ClO2 是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,冷却至11.0℃以下时变成红色液体,易溶于水
见光易分解,易与碱反应,能杀菌,能漂白
(2)2NaClO2+ Cl2 = 2ClO2 +2NaCl 无有害气体生成,产品易分离
(3)①60℃水、冰水 ② NaOH
四、实验与探究(每空1分,共27分)
27.⑴ 氢(或H) 碳(或C) 现象
⑵ ① 木炭燃烧消耗氧气 木炭燃烧虽消耗了氧气,但产生了新的气体,致使集气瓶内气体压强未减少 【说明:其它答案合理即可给分】
② CO2+2NaOH===Na2CO3+H2O 【说明:或写出CO2与KOH、Ca(OH)2等可溶性碱溶液反应的化学方程式也可】 导管内的空气进入集气瓶中(或瓶中的木炭在空气不充足时燃烧,产生了难溶于水的一氧化碳)【说明:其它答案合理即可给分】
③ 药品要能在空气中燃烧;或燃烧时只消耗氧气;生成物最好不是气体;如果生成物是气体,则应用其它物质将其完全吸收……【说明:只要回答上述任意一条即可】
28.(1)A 带火星的木条 (2)除去二氧化碳中的氯化氢气体 (3)NaOH溶液
(4)在D和E之间增加一个气体干燥装置
29.① A (2)①光合 ②甲; CO2 与NaHCO3不会发生反应; SO2与NaHCO3能反应,不但能除去SO2,而且还能增加CO2的含量
(3)
| 方 法 | 现 象 |
| (1)将两种化肥分别放入试管中加热 | 有刺激性气味气体产生,试管壁出现水珠,固体质量减少或消失的 |
| (2)将两种化肥分别放入到装有稀盐酸的试管中 | 有无色无味的气体产生的 |
30.(1)C2H5OH+3O2=2CO2+3H2O
(2)
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 没有 | ||||
| 乙同学 | 有 | 可能有 | |||
| 丙同学 | 没有 | ||||
(3)8.1g
五.计算题(共6分)
31.解: 设:参加反应的氯化钠的质量为x ,生成氢气的质量为y,氢氧化钠的质量为z
![]() 2NaCl + 2H2O Cl2
↑+ H2 ↑+ 2NaOH
2NaCl + 2H2O Cl2
↑+ H2 ↑+ 2NaOH
117 71 2 80
x 7.1g y z
![]() x=11.7
g
x=11.7
g
![]() y=0.2 g
y=0.2 g
![]() z=8 g
z=8 g
反应后所得溶液的质量:![]()
反应后所得溶液中溶质质量分数:![]()
答:略