九年级根据化学方程式计算2
1、 识图题:(氢气的质量==×金属的化合价)
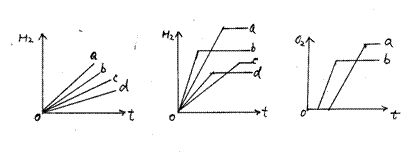
例1、 下图1中a、b、c、d分别对应于Mg、Al、Zn、Fe中的哪一种?
例2、 下图2中a、b、c、d分别对应于Mg、Al、Zn、Fe中的哪一种?
例3、 相同质量的KClO3、KMnO4产生氧气的情况如图3,a、b分别对应于KClO3、KMnO4中的哪一种?
2、 有关含杂质的计算
例1、 往质量为50g的试管中装入氯酸钾和二氧化锰混合物,称总质量为60g,加热氯酸钾完全分解,向试管中加入4g水,振荡仍有4.24g固体未溶解,再加入2g水振荡后仍有3.28g固体未溶解。计算混合物中氯酸钾的质量分数。
例2、 将10g锌放入93.7g未知溶质质量分数的稀盐酸中,当反应停止后,锌有剩余。过滤后,称量溶液的质量比反应前增加了6.3g。求①反应后溶液中溶质的质量分数。 ②剩余锌的质量。
例3、 CV....铜和氧化铜的混合物6g,通入氢气使其反应一会儿停止,剩余固体质量为5.2g,则①反应的氧化铜的质量为多少克?②实际反应的氢气的质量。
例4、 有一种由BaCl2和NaCl组成的固态混合物,取47.1g完全溶解于80g水中,然后加入若干克10%的Na2SO4溶液,恰好完全反应,生成23.3g沉淀。求①混合物中BaCl2的质量;②反应后溶液中溶质的质量分数是多少?
例5、 将铜粉和无水硫酸铜粉未的混合物23g,加入足量的水,充分搅拌后过滤,在滤液中加入 一定量的锌粉恰好完全反应,得到不溶性物质3.2g.。求①参加反应的锌粉质量。②原混合物铜元素的质量分数。
3、 有关质量守恒定律的计算:
例1、 在化学反应 3A +B +2C== 3D 中,如果将A、B、C三种物质各15g混合均匀 后加热生成30gD时,再向残留物中加入10gA,加热继续反应,则反应物中只有C有剩余,则第一次反应停止时剩余C的质量是_____克,第二次时又生成D的质量____克,参加反应的B与C的质量比是______,若C的相对分子质量为m,D的相对分子质量为n,则m与n的比为_______。
例2、 化合物A在空气完全燃烧,共用氧气9.6g。共用去氧气9.6g,生成8.8g二氧化碳,5.4g水。求①化合物中含几种元素?②该化合物的化学式。
4、 无数据计算题:
例1、 氯酸钾、二氧化锰和铜的混合物在空气中加强热,完全反应后剩余固体和原混合物固体质量相等。求原混合物中氯酸钾和铜的质量比。
例2、 碳酸钙和铜的混合物,在空气中加强热,完全反应后剩余固体和原混合物固体质量相等。求原混合物中铜的质量分数。
例3、 向氯化钡溶液中滴加稀硫酸溶液,直到沉淀完全为止,其结果是生成溶液的质量恰好等于原氯化钡溶液的质量,则滴入的硫酸溶液的质量分数为多少?
例4、 将足量的铁片放入氯化铁溶液中,反应为2FeCl3+Fe===3FeCl2。当反应进行到FeCl3和FeCl2溶质质量分数相同时,参加反应的FeCl3和剩余的FeCl3的质量比为多少?
5、 有关天平的计算
例题:左右两盘中各放等质量的烧杯,烧杯中放入等质量等质量分数的盐酸。
①左盘放5.6g铁,右盘放锌多少克才能平衡?
②左盘放5.6g氧化钙,右盘放铁多少克才能平衡?
 ③左盘放11g氧化镁,右盘放碳酸钠多少克才能平衡?
③左盘放11g氧化镁,右盘放碳酸钠多少克才能平衡?
6、 溶解度的题
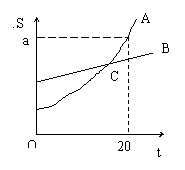
例1、 右图是A和B两物质的溶解度曲线,回答下列问题:
①C点的意义________________________________;
②_____________温度时SB>SA;
③降温时A溶液中析出的晶体比B溶液中析出的晶体_______(填多、少或无法比较)
④20℃,A物质的饱和溶液中,溶质的质量分数为_______________;
⑤若要从B的饱和溶液中得到B物质的晶体,通常采用蒸发溶剂的方法,这是因为____________________________________________。