机密★启用前
高中段学校招生统一考试化学试题
化 学 试 题
考生注意:
1.本试题分选择题、非选择题两部分。共6页,五大题30小题。满分100分。考试时间100分钟。
2.答题前,考生务必将自己的姓名、考试号、座位号填涂在答题卡、答题纸的指定位置。选择题答案填涂在答题卡上,非选择题答案直接写在答题纸上规定位置。
3.考试结束,监考人员将答题纸、答题卡、试卷全部收回。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Al—27 S—32
Cl—35.5 K—39 Ca—40 Fe—56 Cu—64 Ba—137
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.厨房里发生的下列变化,属于物理变化的是
A.剩饭馊了 B.液化气燃烧 C.水沸腾了 D.菜刀生锈
|
这里的氟化钠和二氧化硅都属于
A.盐 B.氧化物
C.单质 D.化合物
3.以下说法正确的是
A.吸带过滤嘴的香烟,对人体无害 B.保护环境就是保护人类自己
C.凡是“绿色食品”均不含化学物质 D.青少年长期饮用纯净水有益健康
4.苍梧晚报报道,我市预计明年四月就可以乘上使用压缩天然气(CNG)为燃料的公交车和出租车。CNG就是将天然气多级压缩后,储存至高压容器中作为燃料。下列叙述不正确的是
A.CNG的主要成分是CH4 B.使用CNG燃料可减小空气污染
C.CNG的主要成分是CH3OH D.CNG完全燃烧的主要产物是二氧化碳和水
5.下列是生产、生活中常见的物质,其名称、俗名、化学式一致的是
A.硫酸铜、胆矾、CuSO4·5H2O B.铁、生铁、Fe
C.乙酸、食醋、CH3COOH D.氢氧化钙、熟石灰、Ca(OH)2
![]()
![]()
![]() 6.下列示意图形象地表示了A( )与B( )反应生成C( )其反应前后分子及数目的变化,则该反应的化学方程式中,
6.下列示意图形象地表示了A( )与B( )反应生成C( )其反应前后分子及数目的变化,则该反应的化学方程式中,
 A、B、C的化学计量数之比为
A、B、C的化学计量数之比为
A.2:1:2 B.1:2:2
C.1:1:1 D.2:2:3
7.今年5月28日央视《每周质量日报》报道,市场销售的一批劣质奶瓶,其酚含量严重超标;酚有毒,少量食入也会产生积蓄,慢慢中毒。苯酚是酚类中的一种,苯酚的化学式为C6H6O,下列关于苯酚的说法不正确的是
A.由碳、氢、氧三种元素组成 B.苯酚属于有机物
C.碳、氢、氧元素的质量比为6:6:1
D.每个分子由6个碳原子、6个氢原子和1个氧原子构成
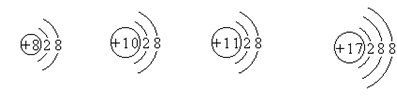 8.对于下列生活中常见元素的微粒结构示意图,有关说法正确的是
8.对于下列生活中常见元素的微粒结构示意图,有关说法正确的是
A.它们都表示离子 B.它们都具有相对稳定结构
C.它们的核外电子排布相同 D.前三种表示同一种元素
9.下列化学实验操作中,先后顺序不正确的是
A.用托盘天平称量物质的质量时,应先调零,后称量
B.制备气体时应先检查装置的气密性,后向装置中加药品
C.点燃可燃性气体时,应先验纯后点燃
D.测定溶液的pH时,应先将pH试纸湿润,后将待测溶液滴在试纸上
10.某同学的化学笔记上有以下知识总结,你认为正确的是
A.生成盐和水的反应不一定是中和反应
B.含有氧元素的化合物称为氧化物
C.由同种元素组成的物质称为单质
D.固体物质的溶解度都随温度的升高而增大
11.向H2SO4和CuSO4的混合溶液中,不断加入NaOH溶液,下列图像横坐标表示加入NaOH溶液质量,纵坐标表示反应的有关变化情况,其中正确的是
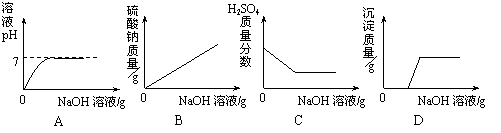 |
12.下列设计方案可行,且化学方程式书写正确的是
A.用NaOH溶液治疗胃酸过多症:NaOH+HCl=NaCl+H2O
B.实验室用稀硫酸与大理石反应制取CO2:H2SO4+CaCO3=CaSO4+CO2↑+H2O
|
D.用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2 === 2CO2
13.以下实验,你认为能达到实验目的的是
A.用酚酞试液鉴别稀硫酸和氯化钠溶液
B.用燃着的木条置于集气瓶口检验CO2是否集满
C.检验未知溶液是否含有SO42- 离子,先加BaCl2溶液,再加稀硝酸
D.用锌粒和稀硝酸反应制取氢气
14.硫的某氧化物中,氧元素的质量分数为60%,则该氧化物中硫元素的化合价为
A.-2 B.+2 C.+4 D.+6
15.氢氧化钠在工业生产中有广泛的用途。下列有关氢氧化钠的叙述,不正确的是
A.氢氧化钠易潮解,可作某些气体的干燥剂
B.称量氢氧化钠时,应将其置于容器中,而不能直接放在纸片上
C.露置在空气中的氢氧化钠部分变质,可用滴加盐酸的方法除去杂质
D.氢氧化钠可用于造纸、纺织、制肥皂等工业中
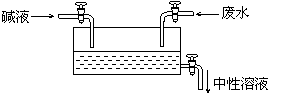 16.某工厂排放的废水中含有硫酸,原来采用氢氧化钠溶液处理,通过调节流量阀,使最终排出的溶液呈中性(见下图)。现改用氢氧化钾溶液处理以得到钾肥,若氢氧化钾溶液中溶质质量分数与原来所用氢氧化钠溶液
16.某工厂排放的废水中含有硫酸,原来采用氢氧化钠溶液处理,通过调节流量阀,使最终排出的溶液呈中性(见下图)。现改用氢氧化钾溶液处理以得到钾肥,若氢氧化钾溶液中溶质质量分数与原来所用氢氧化钠溶液
中溶质质量分数相同(假设两种碱溶液的
密度相同),在废水流量不变的情况下,碱
的流量阀应作的调节为
A.保持不变 B.加大流量
C.减小流量 D.无法确定
17.下列各组物质在溶液中能大量共存的是
A.FeCl2、Na2SO4、HCl B. NaOH、NaCl、HNO3
C.MgSO4、NaNO3、KOH D. Na2CO3、KNO3、HCl
 18.以下是我们熟悉的几种气体,其中可用下图所示
18.以下是我们熟悉的几种气体,其中可用下图所示
装置干燥并收集的是(省略了铁架台等仪器)
①H2 ②O2 ③CO2 ④SO2 ⑤CH4
A.①② B.③④
C.①⑤ D.①②⑤
19.某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:
①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液
②取少量上述溶液,加过量稀硫酸,有气泡产生
③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀
分析以上实验现象,对原固体组成的推断正确的是
A.肯定有Na2CO3、Na2SO4,无FeCl3、Ca(NO3)2
B.肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.肯定有Na2CO3、Na2SO4,无FeCl3
D.肯定有Na2CO3,无FeCl3、KCl
20.小宇同学在托盘天平两端的烧杯内,分别加入等质量、等质量分数的足量稀硫酸,调节天平至平衡。然后向两端烧杯内分别加入等质量的铁、铝铜合金,反应完毕后,天平仍保持平衡,则该合金中铝和铜的质量比为
A.9:19 B.19:9 C.13:1 D.1:13
二、(本题包括 4小题,共 20分)
21.(4分)用正确的化学符号或化学式填空。
⑴+5价的磷元素 ;⑵2个乙醇分子 ;
⑶3个氢氧根离子 ; ⑷碳酸钠晶体 。
22.(8分)按要求写出下列反应的化学方程式,并注明有关反应所属的基本类型(指化合反应、分解反应、置换反应、复分解反应)。
(1)不能用铁桶盛放硫酸铜溶液 ( )
(2)实验室制取氢气 ( )
(3)碳在高温下与二氧化碳反应 ( )
(4)工业上煅烧石灰石制取生石灰 ( )
23.(4分)请你从提供的试剂中,选择一种以除去下列物质中的少量杂质(括号内为杂质)。用所选试剂的序号填空(每种试剂只能选用一次)。
A.H2O B.AgNO3溶液 C.NaOH溶液
D.Na2CO3溶液 E.Ba(NO3)2溶液 F.BaCl2溶液
⑴CO(CO2) ⑵NaOH 溶液[Ca(OH)2] ⑶NaNO3溶液(NaCl) ⑷盐酸(硫酸)
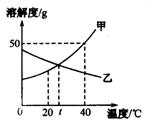 24.(4分)请你用右图所示甲、乙两物质(均不含结晶水)
24.(4分)请你用右图所示甲、乙两物质(均不含结晶水)
的溶解度曲线解决以下问题。
(1)_______℃时甲、乙的溶解度相等。
(2)40℃时100g水中最多能溶解甲_________g。该温度
下甲物质的饱和溶液中,溶质和溶液的质量比为__________。
(3)分别将40℃时甲、乙的饱和溶液(无固体存在)降温至
t℃,所得溶液中溶质的质量分数甲 乙(填“>”或“=”
或“<”)。
三、(本题包括3小题,共16分)
25.(6分)以下列举的是生活和学习中可能遇到的某些情况,根据你所学知识与掌握的技能回答:
⑴通常所说的煤气中毒是指由 引起的中毒;
⑵浓盐酸和浓硫酸敞口久置于空气中,溶质质量分数都减小,其原因分别是 ;
⑶劣质装修材料会散发出甲醛(CH2O),人长时间接触甲醛易患白血病。专家建议新装修的住房不要马上入住,应经常开窗通风。甲醛在空气中完全燃烧时,生成二氧化碳和水。请写出甲醛完全燃烧的化学方程式 ;
⑷刘大爷家的庄稼出现倒伏现象,你会建议他使用化肥中的 肥;
⑸食盐是维持人体正常生理活动的重要物质。某病人因腹泻脱水,医生所开处方中有一瓶500mL生理盐水注射液。已知生理盐水一般含有0.9%的NaCl(密度约为1g/mL),则该生理盐水可为病人补充 g NaCl。
26.(3分)实验室有失去标签的碳酸钾、盐酸、氢氧化钡三瓶无色溶液,为了鉴别它们,现将其任意编号为A、B、C,分别取少量两两混合,实验现象如下:
A、B混合,无明显现象;B、C混合,有白色沉淀产生。则A、B、C依次为(写溶质的化学式) 。
 27.(7分)下列是初中化学中常见的一些物质间的相互转化关系,其中A、E、F、G为单质。
27.(7分)下列是初中化学中常见的一些物质间的相互转化关系,其中A、E、F、G为单质。
回答:(1)M的化学式 ,乙的化学式 ;
(2)乙和稀盐酸反应的基本类型是 ;
(3)写出下列转化的化学方程式:
甲→E+Y ; N→A+D 。
四、(本题包括2小题,共16分)
28.(5分)以下是实验室常用的仪器,你认识吗?请用它们的名称回答以下问题。
 |
⑴B是 ,D是 ;
⑵滴加溶液常用 ;取用粉末状固体常用 ;
⑶用固体物质配制一定溶质质量分数的溶液时,除上述仪器外,还需要的一种仪器是
。
29.(11分)一包黑色粉末可能由氧化铜、木炭粉中的一种或两种组成。为探究其组成,某化学兴趣小组的学生选择以下部分装置进行实验。
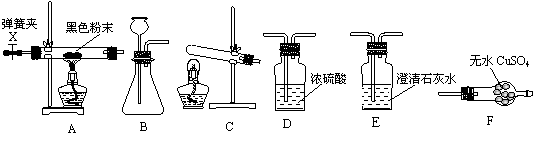 |
⑴小亮用装置A 与E连接,关闭弹簧夹X,给排尽空气后的盛有黑色粉末的硬质玻璃管加热。一段时间后,若黑色粉末变红色,澄清石灰水变浑浊,则可判断该黑色粉末的成分是 ① ,写出产生上述现象时,玻璃管内物质发生反应的化学方程式 ② ;
若黑色粉末不变色,澄清石灰水也不变浑浊,则无法确定黑色粉末的成分。
为进一步确定其成分,小明帮助小亮又进行如下实验:他将干燥的氢气与A中的黑色粉末反应,并检验其产物。你认为他应选择的仪器装置以及连接顺序依次为 ③ (填字母代号),在给黑色固体加热前,应先通入氢气,目的是 ④ 。若实验现象为 ⑤ ,
则黑色粉末的成分是氧化铜;若无上述实验现象则为木炭。
⑵除上述方法外,小强又设想出另一种简单易行的实验方法:取少量粉末于试管中,再加入过量 试剂(填试剂名称),实验中可能出现的现象与对应的结论如下表所示(表中未列完所有情况),请你完成下表:
| 实验现象 | 结论 | |
| ① | 有黑色不溶物,溶液呈蓝色 | |
| ② | 只含C | |
| ③ |
五、(本题共8分)
|
工人小李用该浓硫酸配制20%的稀硫酸,以清洗
钢铁表面的铁锈。他在配制该溶液时所用98%的
浓硫酸与水的质量比应该为 。
⑵某固体物质由氯化钠和氯化钡组成,取32.8g
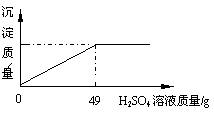 该固体混合物完全溶于水,并逐滴加入上述20%的
该固体混合物完全溶于水,并逐滴加入上述20%的
稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图
所示关系,计算32.8g固体混合物中氯化钠和氯化钡
的质量。
⑶若加入的稀硫酸刚好使沉淀达最大量时,将所
得混合物过滤、洗涤,得滤液200g(过程中损耗忽略不计),计算该滤液中溶质的质量分数。(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)[注:⑵、⑶两问需写出计算过程]。