高中阶段学校招生考试化学试卷
本试卷分为第1卷(选择题)和第二卷(非选择题)两部分,满分100分。考试时间80分钟。
第一卷选择题(共40分)
一、选择题 注意:每道选择题有四个选项,其中只有一项符合题意。选错、不选、多选或涂改不清的,均不给分。
1.家庭中的下列现象,属化学变化的是 ( )
(A)晾干湿衣服 (B)弯曲电线 (C)点燃煤气 (D)摔碎玻璃杯
2.在人体和地壳所含的元素中,质量分数最大的是 ( )
(A)氮 (B)氧 (C)碳 (D)氢
3.下列各组物质中,属同一种元素组成的单质是 ( )
(A)金刚石、石墨、C60
(B)氧气、氢气、氮气
(C)煤、石油、天然气
(D)水、冰、干冰
4.回收利用日常生活中废弃的一些用品,可以减少对环境的污染。下列废弃用品中属有机化合物的是( )
(A)铜线 (B)铝制易拉罐 (C)铁锅 (D)塑料包装袋
5.烧杯是实验室常用仪器,下述实验中要使用烧杯的是 ( )
①用固体溶质配制一定质量分数的溶液
②用高锰酸钾制氧气
③稀释浓硫酸
(A)①② (B)①③ (C)②③ (D)①②③
6.有一瓶长时间露置于空气中的氢氧化钠溶液,要除去其中杂质,得到纯净的氢氧化钠溶液,下列操作可以达到目的的是 ( )
(A)过滤后加入适量稀硝酸
(B)先过滤,然后小心蒸发
(C)加入适量盐酸,过滤
(D)加入适量氢氧化钙溶液,过滤
7.要比较CuSO4、FeSO4、CaSO4相对分子质量的大小,最简单的方法是 ( )
(A)分别计算它们的相对分子质量
(B)计算所含S04-2的质量分数
(C)比较Cu、Fe、Ca相对原子质量
(D)计算所含金属元素的质量分数
8.人体内的钙,99%存在于骨骼和牙齿中,主要以羟基磷酸钙[Cal0(PO4)6(OH)2]晶体的形式存在。以下对羟基磷酸钙的认识,错误的是 ( )
(A)它是有机高分子化合物
(B)它是无机化合物
(C)它由钙、磷、氢、氧四种元素组成
(D)它的组成中钙原子与磷原子的个数比为5:3
9.请你分析下列事实,其中能证明分子是可分的是( )
(A)冷却热饱和硝酸钾溶液有硝酸钾晶体析出
(B)海水晒干得到食盐晶体
(C)水通电得到氢气和氧气
(D)水受热变成水蒸气
10.有人用下列方法除去硬水中某些可溶性钙镁化合物,以降低水的硬度,你认为可行的是 ( )
(A)煮沸 (B)降温析出 (C)过滤 (D)加盐酸
11.实验室用棕色试剂瓶盛浓硝酸,由此猜测浓硝酸可能具有的性质是 ( )
(A)它是深棕色溶液
(B)它是稳定的化合物
(C)它是易跟空气反应的物质
(D)它是见光易分解的物质
12.要用燃烧法测定空气的成分,可选用下列物质中的 ( )
(A)红磷 (B)木炭 (C)酒精 (D)蜡烛
13.含磷洗涤剂含有Na5PxO10,其洗涤废水任意排放会造成环境污染。已知在该化合物中磷的化合价为+5,则x应为 ( )
(A)1 (B)2 (C)3 (D)4
14.有人设计下列实验步骤,用NaCl固体配制50g5%的NaCl溶液,其中不必要的是 ( )
(A)计算,确定所需NaCl和水的质量
(B)称量,按计算结果称取NaCl,量取水
(C)溶解,将称好的NaCl溶解于水中
(D)验算,计算所配溶液的溶质质量分数
15.常温时,向硝酸钾不饱和溶液中加入硝酸钾,使其变成饱和,溶液中没有发生变化的是 ( )
(A)溶液的质量 (B)溶质的质量
(C)溶剂的质量 (D)溶质的质量分数
16.下面各组金属只用硫酸亚铁溶液,就能比较它们的活动性强弱的是 ( )
(A)铜和银 (B)铜和锌 (C)汞和铜 (D)铅和汞
17.某电镀厂排出的污水,其pH<7,并含有硫酸铜,要除去有毒的硫酸铜.同时调节pH至中性,可选用下列物质中的 ( )
(A)生石灰 (B)氯化钡 (C)硝酸银 (D)碳酸钙
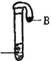 18.如图所示,试管中盛有pH=1的无色溶液A,将气球中的固体B倒入溶液A中,观察到有无色气泡产生,且气球胀大。B不可能是 ( )
18.如图所示,试管中盛有pH=1的无色溶液A,将气球中的固体B倒入溶液A中,观察到有无色气泡产生,且气球胀大。B不可能是 ( )
|
19.初中化学里,我们学习过以下常见的酸、碱、盐:NaOH、Ca(OH)2、HCl、
H2S04、Na2C03,请你整理归纳,这五种物质两两相互能发生化学反应的共有 ( )
(A)4组 (B)5组 (C)6组 (D)7组
20.某白色粉末可能含有CaCl2、Na2S04、Ba(N03)2、K2CO3中的一种或几种。把该粉末放入足量水中,充分搅拌,仍然有白色物质不能溶解I加入过量稀盐酸后,不溶物全部溶解;继续加入BaCl2溶液,没有明显现象。该粉末中肯定没有的物质是 ( )
(A)CaCl2 (B)Na2SO4 (C) Ba(NO3)2 (D)K2CO3
第Ⅱ卷 非选择题(共60分)
二、本题包括3小题,共10分。
21.(2分)某农田作物需施含氮元素的化肥。如果施用了尿素[化学式为CO(NH2)2]120kg,含氮_______kg。
22.(2分)农业生产上,常需用质量分数为16%的食盐水来选种。现有质量分数为20%的氯化钠溶液5000g,将该溶液稀释成所需溶液,要加水_______g。
23.(6分)实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5g,加入1gMnO2,完全反应后称得剩余物的质量为41.9g。计算:
(1)反应中放出氧气的质量。
(2)实验中加入的过氧化氢溶液的质量分数。
三、本题包括5小题,共25分。
24.(2分)煤是复杂的混合物,主要含有碳元素。煤完全燃烧时,会排放出SO2和NO2。等污染物(酸雨的主要来源之一)。根据以上事实,请你作出推测, 煤的成分中还含有(写元素符号) _______ 等元素。
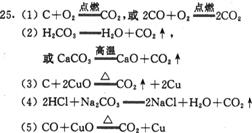
25.(5分)初中化学涉及许多化学反应类型,请你整理归纳,按以下化学反应类型选择合适的反应物质,各举一例,要求有二氧化碳生成,用化学方程式表示,并注明反应条件。
(1)化合反应_____________________
(2)分解反应_____________________
(3)置换反应_____________________
(4)复分解反应_____________________
(5)不属于上述反应类型的反应____________________________
26.(4分)物质X与Y充分化合,可得到Z;X与CuO反应,也有Z生成。请根据以上信息作出推测:
(1)如果X是单质固体,则X是(写化学式) _____________________
(2)如果X是氧化物,则X是(写化学式) ____________________________
27.(4分)现有甲、乙、丙、丁四种化合物。已知这四种化合物都是由Na、H、S+6、C+4、O五种元素中的三种组成。并且甲+乙→丙+H2O,乙+丁→丙+H2O+CO2↑,其余两两混合均不反应。根据上述提供的物质变化和物质组成的信息,请你写出它们的化学式:
甲是_______ 乙是_______; 丙是_______;丁是_______。
28.(10分)A、B、C、D、E为无色气体,W、X、Y、Z是四种不同类别的物质,它们之间能发生如下变化,其中变化⑥是实验室制备E的常用方法(图中略去部分反应的产物)。
请你根据初中化学学习过的常见物质的知识和以下信息作出推断。
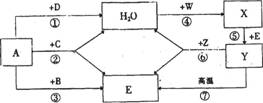
(1)写出下列物质的化学式
A ______________ B______________
C ______________ D______________
(2)写出下列变化的化学方程式
变化④__________________________________________
变化⑤__________________________________________
(3)A~Z九种物质,能使紫色石蕊试液显红色的是(填化学式)_________________________。
四、本题包括4小题,共25分。
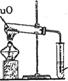
29.(2分)右图是碳和氧化铜在一定条件下进行反应的实验装置,该反应需几分钟时
间。最能说明这个反应已经完成的实验现象是_____________________
![]()
 __________________________________________。
__________________________________________。
30.(4分)实验室利用右图所示
装置进行加热高锰酸钾制氧气的实验。
(1)写出图中A、B仪器的名称:
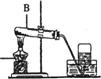 A是___________________;
A是___________________;
B是___________________。
|
31.(4分)设计两种不同的实验,证明二氧化碳通入水时,确实发生了化学反应。请分别写出这两个实验过程中的实验现象和结论。
(1)实验一_________________________________________________________
(2)实验二_________________________________________________________
32.(15分)某工厂的废水只含硫酸镁和少量硫酸,课外活动小组以此作为课题,探讨如何从中回收纯净的硫酸镁固体。他们设计了两种不同的方案,请你参加讨论:
(1)方案一,选用镁粉为试剂。
①往废水中逐次加入镁粉,当观察到时,说明加入镁粉的量已经足够。此过程发生反应的化学方程式是_________________________________________________________;
②接下来的操作方法依次是_________________________________和________________
______________________________________
(2)方案二,选用氢氧化钠溶液为试剂。
①向废水中逐滴加入氢氧化钠溶液,当______________________________________时,停止滴入氢氧化钠溶液。此过程发生反应的化学方程式是:______________________________ ______________________________________________
②为了得到纯净的硫酸镁溶液,接着应进行的实验操作是(请简要写出操作过程)
③……,得到硫酸镁固体。
(3)比较两个方案,假设实验中都没有损耗,那么,最后得到的硫酸镁固体的质量是否相同? _______________,原因是______________________________________。
(4)请你继续探究,设计新的方案(使用的试剂必须是与镁粉和氢氧化钠属不同类别):
你选用的一种试剂是(写化学式) ______________________________________;
该试剂发生反应的化学方程式是______________________________________。
答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | A | D | B | D | C | A | C | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | A | C | D | C | B | A | D | D | B |
二、
21.56
22.1250
23.解:(1)放出02的质量为:
42.5g+1g一41.9 g=1.6g
(2)设参加反应的过氧化氢的质量为x
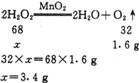
过氯化氢的质量分数为t3.4 g÷42.5 g×100%=8%
答:反应中放出02的质量为1.6 g,原过氧化氢溶液的质量分数为8%。
24.S。N
(其他合理的答案均可给分)
26. (1) C, (2) CO
27. NaOH H2SO4 Na2SO4 Na2CO3
28. (1) O2,CO, CH4,H2;
![]()
(3) CO2 ,HCl
四、
29.装有澄清石灰水的试管中不再有气泡冒出
30.(1)酒精灯,试管
(2)酒精灯(或A),试管在酒精灯外焰上加热
31.(1)将C02通入水中,再滴入紫色石蕊试液,溶液显红色,说明有酸生成
(2)测试水的导电性,通入CO:后的水比纯水的导电能力强,说明有酸生成
32.(1)①镁粉有剩余,溶液中不再有气泡产生
![]()
②过滤,蒸发。
(2)①不再生成沉淀
![]()
②过滤,取出沉淀,加入稀硫酸,至沉淀恰好完全溶解
(3)不同,方案一中加入了镁粉,增加了硫酸镁的质量,
![]()
(其他合理的答案均可给分)